Сулфорапхане је фитокемикалија, супстанца у оквиру изотиоцијанатне групе органских једињења сумпора, која се налази у поврћу крсташа, као што су броколи, купус, карфиол и прокулице. Такође се може наћи у бок чоју, кељу, огрлици, сенфу и поточарки. Истраживања су показала да сулфорафан може помоћи у превенцији различитих врста рака активирање производње Нрф2, или фактор везан за нуклеарни фактор еритроид 2, фактор транскрипције који регулише заштитне антиоксидативне механизме који контролишу одговор ћелије на оксидансе. Сврха следећег чланка је да опише функцију сулфорафана.
Садржај
Апстрактан
КЕАП1-Нрф2-АРЕ антиоксидативни систем је главно средство помоћу којег ћелије реагују на оксидативни и ксенобиотски стрес. Сулфорафан (СФН), електрофилни изотиоцијанат добијен из поврћа крсташа, активира пут КЕАП1-Нрф2-АРЕ и постао је молекул од интереса у лечењу болести у којима хронични оксидативни стрес игра главну етиолошку улогу. Овде демонстрирамо да митохондрије култивисаних ћелија ретиналног пигментног епитела (РПЕ-1) третираних СФН пролазе кроз хиперфузију која је независна и од Нрф2 и од његовог цитоплазматског инхибитора КЕАП1. Пријављено је да је митохондријална фузија цитопротективна тако што инхибира формирање пора у митохондријама током апоптозе, и у складу са овим, показујемо Нрф2 независну, цитопротекцију ћелија третираних СФН изложеним индуктору апоптозе, стауроспорину. Механички, СФН ублажава регрутовање и/или задржавање растворљивог фисионог фактора Дрп1 у митохондрије и пероксизоме, али не утиче на укупну заступљеност Дрп1. Ови подаци показују да се корисна својства СФН-а протежу даље од активације система КЕАП1-Нрф2-АРЕ и захтевају даље испитивање с обзиром на тренутну употребу овог агенса у више клиничких испитивања.
Кључне речи: Сулфорафан, Нрф2, Дрп1, митохондрије, фисија, фузија, апоптоза
увод
Сулфорафан је Нрф2-независни инхибитор митохондријалне фисије
Сулфорафан (СФН) је изотиоцијанатно једињење које се добија у исхрани најчешће из поврћа крсташа [56]. Генерише се у биљкама као ксенобиотски одговор на грабеж преко везикуларног ослобађања хидролитичког ензима мирозиназе из оштећених ћелија; овај ензим претвара глукозинолате у изотиоцијанте [42]. Током последње две деценије, СФН је опсежно окарактерисан због својих пријављених антиканцерогених, антиоксидативних и антимикробних својстава [57]. Велики део ове ефикасности се приписује капацитету СФН-а да модулира сигнални пут елемента одговора антиоксиданса КЕАП1-Нрф2 (АРЕ), иако су идентификоване додатне активности једињења, укључујући инхибицију активности хистон деацетилазе и прогресију ћелијског циклуса [ 29]. Нрф2 је главни антиоксидативни транскрипциони фактор и у условима хомеостазе, његова стабилност је потиснута деловањем цитоплазматског комплекса Цуллин3КЕАП1 убиквитин лигазе [20]. Конкретно, Нрф2 се регрутује у лигазу Цуллин3КЕАП1 везивањем за димерни адаптер супстрата КЕАП1 и затим се модификује полиУб ланцима који циљају фактор транскрипције за деградацију посредовану протеазомима. Овај конститутивни обрт ограничава полуживот Нрф2 у ћелијама без стреса на ~15 мин [30], [33], [46], [55]. Као одговор на бројне типове стреса, пре свега оксидативни стрес, КЕАП1, протеин богат цистеином, делује као редокс сензор, а оксидативна модификација критичних цистеина, посебно Ц151, КЕАП1 одваја Нрф2-КЕАП1 од ЦУЛ3 и на тај начин спречава деградацију Нрф2 [ 8], [20], [55]. Значајно је да СФН, а можда и други активатори Нрф2, опонашају оксидативни стрес модификовањем Ц151 КЕАП1, нпр. [21]. Стабилизација Нрф2 омогућава његову транслокацију у језгро где индукује експресију батерије антиоксиданса и гена за детоксикацију фазе ИИ. Нрф2 се везује за елементе промотера антиоксидативног одговора (АРЕ) својих сродних циљних гена путем хетеродимеризације са малим Маф протеинима [19]. Овај систем представља динамичан и осетљив одговор на индиректне антиоксиданте као што је СФН, слободне радикале које стварају митохондрије [16] или друге физиолошке изворе оксидативног стреса [41].
Митохондрије су динамичке, субћелијске органеле које регулишу мноштво ћелијских функција у распону од производње АТП-а и интрацелуларног пуферовања калцијума до редокс регулације и апоптозе [13], [49]. Митохондрије такође представљају главни извор реактивних врста кисеоника (РОС) унутар ћелије. Одговарајућа регулација митохондријалне функције је стога неопходна за оптимизацију производње АТП-а како би се задовољиле ћелијске потребе док се истовремено минимизирају потенцијално штетни ефекти прекомерне производње слободних радикала. Критични захтев за фину модулацију митохондријалне функције је капацитет митохондрија да функционишу и независно као биохемијске машине и као део огромне мреже која реагује.
Морфологија и функција митохондријалне мреже су одређене регулисаном равнотежом између фисије и фузије. Митохондријална фисија је неопходна за наслеђивање митохондрија ћерке ћелије током ћелијске деобе [28], као и за селективну, аутофагичну деградацију деполаризованих или оштећених митохондрија, названу митофагија [1]. Супротно томе, фузија је потребна за комплементацију митохондријалних генома и дељење компоненти ланца транспорта електрона између суседних митохондрија [54]. На молекуларном нивоу, фисија и фузија митохондрија су регулисани великим ГТПазама сличним динамину. Три ензима првенствено регулишу фузију: митофузини 1 и 2 (Мфн1/2) су двопролазни протеини спољашње мембране који посредују у фузији спољашње мембране путем хетеротипских интеракција између суседних митохондрија [15], [25], [37], док је ОПА1 унутрашњи мембрански протеин који истовремено обезбеђује повезаност матрикса регулацијом стапања унутрашњих мембрана [5]. Активност ГТПазе сва три протеина је потребна за робусну фузију [5], [18], а ОПА1 је даље регулисан комплексном протеолизом унутар унутрашње мембране митохондрија помоћу протеаза ОМА1 [14], ПАРЛ [6] и ИМЕ1Л [45]. ]. Важно је да је потенцијал интактне митохондријалне мембране неопходан за ефикасну фузију како би се сузбила интеграција оштећених и здравих митохондрија [26].
Митохондријалну фисију првенствено катализује цитосолни протеин који се зове протеин 1 повезан са Динамином (Дрп1/ДНМ1Л). Дрп1 се регрутује из цитосола до потенцијалних места фисије на спољашњој мембрани митохондрија [43]. Главни рецептори за Дрп1 на спољној мембрани су митохондријски фактор фисије (Мфф) [32] и, у мањој мери, фисија 1 (Фис1) [51]. Поред тога, откривен је рецептор за мамце, МИЕФ1/МиД51, који делује на даље ограничавање активности Дрп1 протеина на потенцијалним местима фисије [58]. Једном када се причврсти на спољну мембрану митохондрија, Дрп1 олигомеризује у спиралне структуре око тела митохондрија, а затим користи енергију добијену хидролизом ГТП да посредује у физичком цепању спољашње и унутрашње мембране митохондрија [17]. Тубули изведени из ендоплазматског ретикулума делују као почетни констриктор митохондрија пре Дрп1 олигомеризације, наглашавајући откриће да су неконстриктиране митохондрије шире од дозвољеног обима завршене Дрп1 спирале [12]. Динамика актина је такође важна за интеракције ЕР-митохондрија које претходе фисији митохондрија [24]. Поред своје улоге у фисији митохондрија, Дрп1 катализује фисију пероксизома [40].
Дрп1 је веома сличан добро окарактерисаном динамин протеину по томе што оба протеина садрже Н-терминални ГТПазни домен, средњи домен који је критичан за самоолигомеризацију и Ц-терминални ГТПазни ефекторски домен [31]. Дрп1 постиже селективност за митохондријалне мембране комбинацијом интеракција са својим рецепторским протеинима Мфф и Фис1, као и кроз свој афинитет за митохондријски-специфични фосфолипидни кардиолипин преко јединственог Б-инсерт домена Дрп1 [2]. Дрп1 типично постоји као хомотетрамер у цитоплазми, а склапање вишег реда на местима фисије митохондрија је посредовано средњим доменом Дрп1 [3].
С обзиром на имплицитну везу између митохондријалне функције и пута КЕАП1-Нрф2-АРЕ, истражили смо ефекте активације Нрф2 на структуру и функцију митохондрија. Овде показујемо да СФН индукује митохондријалну хиперфузију која је, неочекивано, независна и од Нрф2 и од КЕАП1. Овај ефекат СФН-а је кроз инхибицију функције Дрп1. Даље показујемо да СФН даје отпорност на апоптозу која је независна од Нрф2 и опонаша оно што је примећено у ћелијама осиромашеним Дрп1. Ови подаци заједно указују да поред стабилизације и активирања Нрф2, СФН модулира митохондријалну динамику и чува ћелијску кондицију и опстанак.
Резултати
Сулфорафан изазива Нрф2/КЕАП1-независну хиперфузију митохондрија
Током проучавања ефеката активације Нрф2 на динамику митохондријалне мреже, открили смо да третман бесмртних ћелија пигментног епитела ретине (РПЕ-1) сулфорафаном (СФН), моћним активатором Нрф2 сигнализације, изазива снажну фузију митохондријалну мрежу у поређењу са контролним ћелијама третираним возилом (слике 1А и Б). Морфологија митохондрија у овим ћелијама је у великој мери подсећала на ону митохондрија у ћелијама осиромашеним сиРНА ендогеног Дрп1, главног фактора фисије митохондрија (слика 1А). Овај резултат је покренуо интригантну идеју да статус митохондријске фисије и фузије реагује директно на нивое Нрф2 у ћелији. Међутим, стимулација ћелија са другим Нрф2 стабилизаторима и активаторима као што је инхибитор протеасома МГ132, прооксидант тБХК, или срушење Нрф2 инхибитора КЕАП1 није изазвало фузију митохондрија (Слике 1А и Б). Стабилизација Нрф2 овим манипулацијама је потврђена Вестерн блоттингом за ендогени Нрф2 (слика 1Ц). Штавише, експресија Нрф2 је била неопходна за фузију митохондрија изазвану СФН, пошто обарање ендогеног Нрф2 са сиРНА није успело да се супротстави овом фенотипу (Слика 1Д�Ф). Пошто СФН стимулише пут КЕАП1-Нрф2-АРЕ ковалентном модификацијом цистеинских остатака КЕАП1 [21], срушили смо КЕАП1 да бисмо решили да ли се хиперфузија митохондрија изазвана СФН стимулише путем КЕАП1 зависног, али Нрф2 независног пута. Међутим, исцрпљивање КЕАП1 такође није успело да поништи фузију митохондрија изазвану СФН (слика 1Г И). У ствари, СФН је преокренуо морфологију профисије изазвану исцрпљивањем КЕАП1 (слика 1Г, панел б у односу на панел д). Ови резултати указују на то да СФН третман узрокује митохондријалну фузију независно од канонског пута КЕАП1-Нрф2-АРЕ и навели су нас да испитамо да ли СФН директно утиче на компоненте митохондријалне фисије или машинерије за фузију.
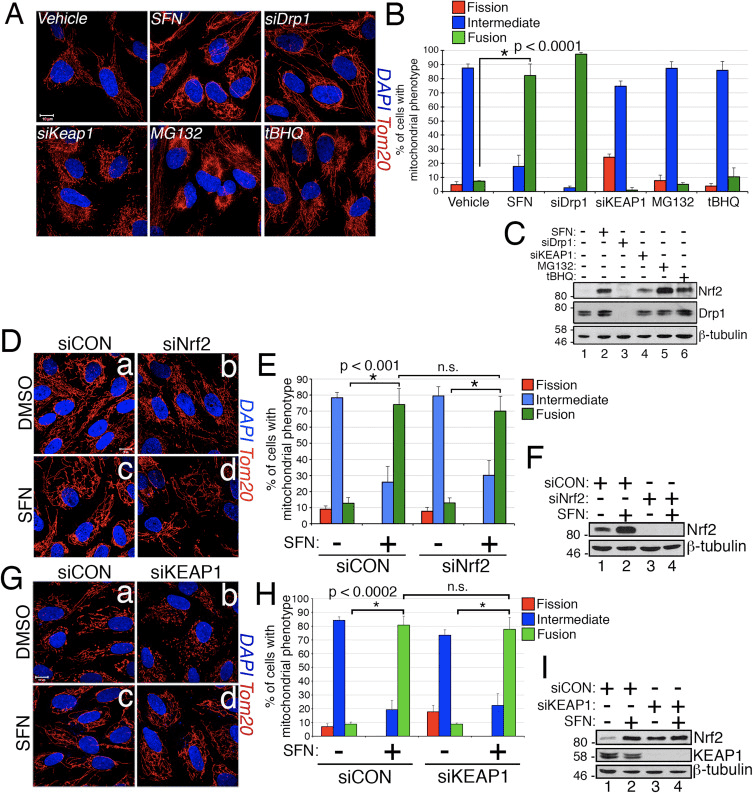
Сулфорафан оштећује митохондријску асоцијацију Дрп1
На основу налаза да СФН-третман индукује митохондријалну хиперфузију, закључили смо да је овај фенотип или последица прекомерне фузионе активности или инхибиције активности фисије. Да бисмо разликовали ове две могућности, упоредили смо морфологију пероксизома у присуству и одсуству СФН. Пероксизоми су слични митохондријима по томе што су динамичке органеле чији се облик и дужина стално мењају [44]. Пероксизоми садрже и Фис1 и Мфф у својој спољној мембрани и, као последица тога, представљају мете за Дрп1 посредовану фисију [22], [23]. Међутим, пероксизоми не користе машинерију фузије митохондријалне мреже и сходно томе не пролазе кроз фузију [39]. Уместо тога, пероксизомалној фисији се супротставља продужавање постојећих пероксизома де ново додавањем мембрана и протеина [44]. Пошто пероксизомима недостају Мфн1/2 и ОПА1, закључили смо да ако СФН активира фузиону машинерију уместо да инхибира машинерију фисије, дужина пероксизома неће бити погођена. У ћелијама третираним носачем, пероксизоми се одржавају као кратке, округле, пунктиформне органеле (слика 2, панели б и д). Међутим, СФН третман је повећао дужину пероксизома за ~2 пута у поређењу са контролним ћелијама (слика 2, панели ф и х). Штавише, многи пероксизоми су били стегнути близу центра, што указује на потенцијални дефект цепања (слика 2, табла х, врхови стрелица). Исто тако, пероксизоми у ћелијама трансфицираним са Дрп1 сиРНА били су абнормално дуги (слика 2, панели ј и л), што потврђује да је Дрп1 неопходан за пероксизомалну фисију и сугерише да СФН-третман узрокује митохондријалне и пероксизомалне фенотипове ометањем машине за фисију.
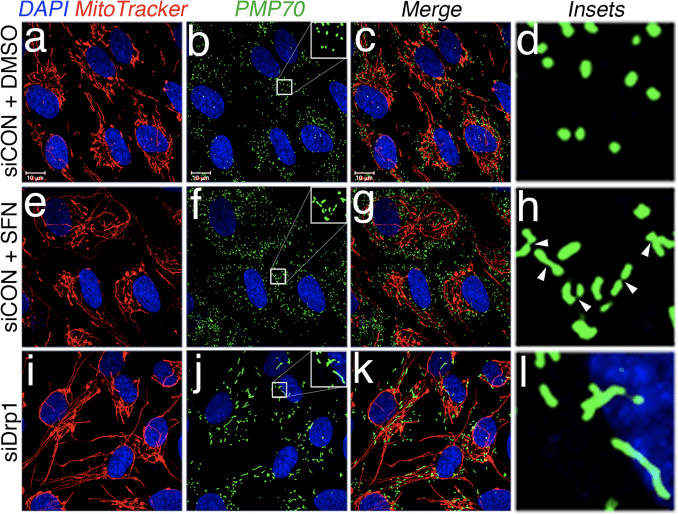
Затим смо утврдили како СФН ограничава функцију Дрп1. Могућности су укључивале смањење нивоа експресије, регрутовање/задржавање у митохондријама, олигомеризацију или ензимску активност ГТПазе. Дефицит у било ком од њих би резултирао смањеном фисијом и хиперфузијом митохондрија. Нисмо открили поновљиве промене у нивоима протеина Дрп1 након третмана са СФН (слике 1Ц и 3А), и стога смо закључили да СФН не мења стабилност или експресију Дрп1, у складу са Дрп1 који има полуживот од >10 х [50] а наши СФН третмани су краћег трајања. Затим смо истражили да ли СФН утиче на регрутовање или задржавање Дрп1 у митохондријама. Студије фракционисања су показале да СФН изазива губитак Дрп1 из митохондријалне фракције (слика 3А, траке 7А8 и слика 3Б). Као што је раније објављено [43], само мањи део Дрп1 (~3%) је повезан са митохондријалном мрежом у било ком тренутку током услова стабилног стања са већином ензима који се налази у цитоплазми (слика 3А, траке 5�8 ). Ови подаци о фракционисању су потврђени коришћењем анализе ко-локализације која је показала смањење од ~40% у митохондријама локализованим, тачкастим Дрп1 жариштима након СФН-третмана (Слике 3Ц и Д). Заједно, ови подаци указују на то да је митохондријска фузија изазвана СФН-ом, барем делимично, последица ослабљене повезаности Дрп1 са митохондријама. Наши подаци не праве разлику између тога да ли СФН омета регрутацију митохондрија у односу на митохондријску ретенцију Дрп1, или обоје, јер анализа ендогеног Дрп1 није била подложна визуелизацији ГТПазе микроскопијом живих ћелија.
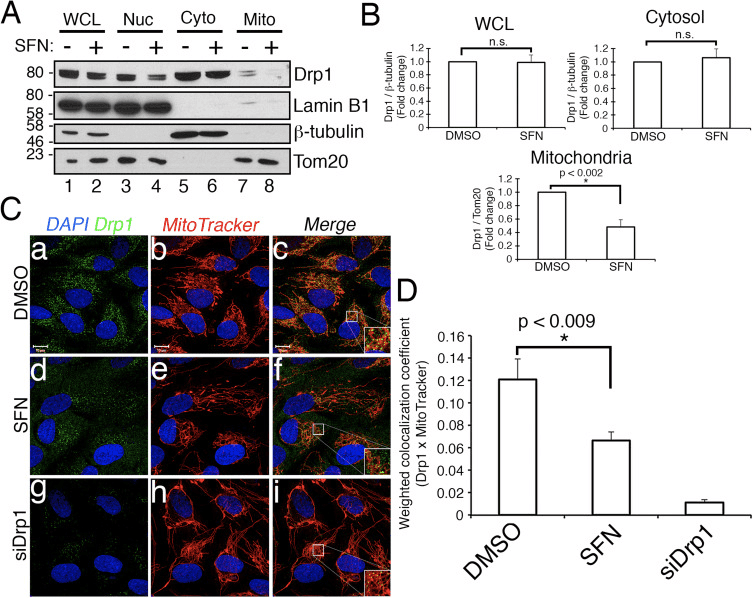
Сулфорафан пружа заштиту од апоптозе изазване стауроспортином независно од Нрф2
Претходни рад је показао да је фисија митохондрија дозвољена у формирању пора у спољашњој митохондријалној мембрани које генерише Бак/Бак током апоптозе [11]. Показало се да се Дрп1 селективно регрутује у митохондрије током апоптозе [11] и, у складу са овим, фрагментоване митохондрије су примећене рано у процесу [27]. Супротно томе, сматра се да инхибирање фисије митохондрија инхибира апоптозу блокирањем формирања поре спољашње мембране које омогућавају ослобађање цитокрома ц [53]. Сходно томе, стимулација митохондријалне фузије одлаже напредовање апоптозе изазване једињењима укључујући стауроспорин (СТС) [14]. Да бисмо утврдили да ли СФН штити ћелије РПЕ-1 од апоптозе посредоване СТС-ом и ако јесте, да ли је за то потребан Нрф2, успоставили смо тест за лако индуковање цепања поли АДП рибозе полимеразе (ПАРП), супстрата активиране каспазе-3 и дефинитивног маркера апоптоза. Третман РПЕ-1 ћелија са 1 µМ СТС током 6 х је изазвао само веома скромно цепање ПАРП-а, али је то спречено СФН ко-третманом (нпр. слика 4А, трака 3 наспрам 4). Да бисмо повећали робусност овог теста, додатно смо сензибилизирали ћелије на апоптозу изазвану СТС-ом тако што смо их претходно третирали сиРНА која циља на анти-апоптотички фактор, Бцл-КСЛ. Овај предтретман је смањио експресију Бцл-КСЛ и значајно унапредио цепање ПАРП-а у функцији времена изложеног СТС-у (слика 4Б, упореди траку 2 са стазама 4×10). Важно је да је 2 х претходног третмана са СФН ублажио цепање ПАРП у ћелијама изложеним СТС (Слика 4Ц, трака 3 наспрам 4 и трака 5 наспрам 6). Слично томе, ћелије које су стабилно осиромашене Нрф2 од стране ЦРИСПР/Цас9 биле су упоредиво заштићене од СТС токсичности СФН предтретманом (слика 4Ц, трака 11 наспрам 12 и трака 13 наспрам 14 и слика 4Д). Ова заштита је примећена коришћењем ПАРП цепања (Слика 4Ц и Д) и ћелијске морфологије (Слика 4Е) као очитавања. Ефикасност исцрпљивања Нрф2 помоћу ЦРИСПР/Цас9 потврђена је Вестерн блотингом (слика 4Ц, Нрф2 блот). Као што је предвиђено, осиромашене ћелије Дрп1, које такође стварају хиперфузиони фенотип (Слика 1А), такође су блокирале цепање ПАРП-а као одговор на СТС у поређењу са контролним ћелијама инкубираним са СФН (Слика 4Ф и Г). Заједно, ови налази су у складу са СФН који пружа заштиту од апоптозе кроз свој капацитет да ограничи функцију Дрп1, независно од стабилизације и активације Нрф2.
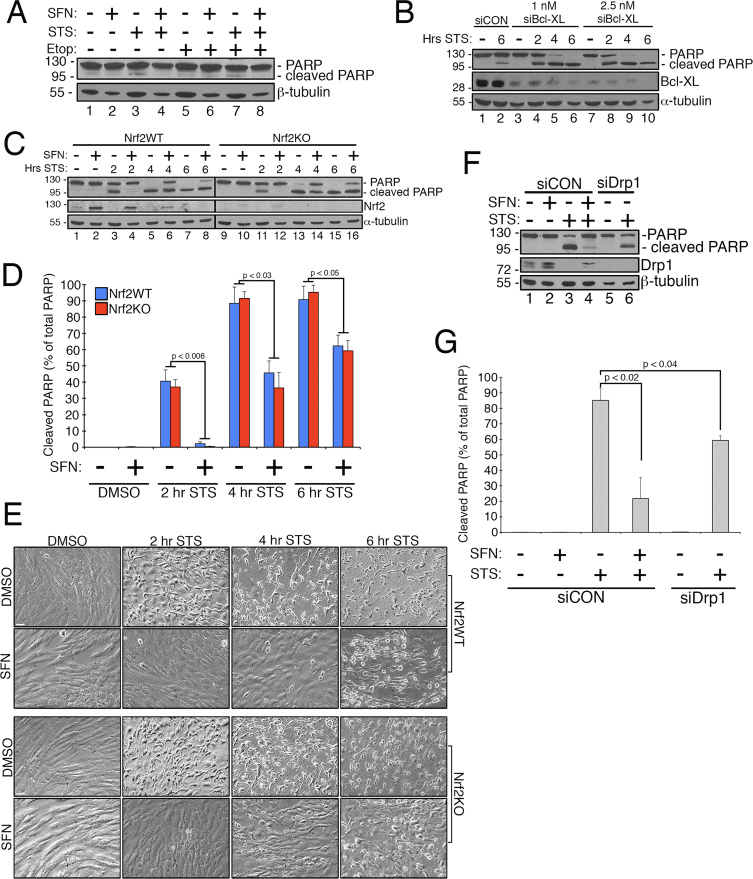
Дискусија
Открили смо да СФН модулира динамику фисије/фузије митохондрија независно од његових ефеката на КЕАП1-Нрф2-АРЕ пут. Ово је интригантно због претпостављене везе између митохондријалне дисфункције и производње РОС-а и неопходности гушења слободних радикала добијених из митохондрија кроз активацију Нрф2. Овај додатни функционални утицај СФН-а је од потенцијалног значаја с обзиром на више од 30 клиничких испитивања која су тренутно у току и тестирају СФН за лечење разних болести укључујући рак простате, опструктивну болест плућа и болест српастих ћелија [7], [10], [ 47].
Пошто је СФН изотиоцијанат [56] и активира Нрф2 сигнализацију директним ацилирањем критичних КЕАП1 цистеина да би сузбио деградацију Нрф2 [21], следи да СФН испољава своје профузионе ефекте модулацијом активности фисије или фактора фузије путем модификације цистеина. . Наши подаци снажно подржавају да Дрп1 негативно регулише СФН, иако остаје да се разјасни да ли је ГТПаза директна мета ацилације. Упркос овом јазу у знању, функција Дрп1 је очигледно угрожена од стране СФН, пошто и митохондрије и пероксизоми постају хиперфузионисани као одговор на СФН третман и ове органеле деле Дрп1 за своје одговарајуће догађаје цепања [38]. Поред тога, СФН смањује количину Дрп1 која се локализује и акумулира у митохондријама (Сл. КСНУМКС). Пошто су наши експерименти обављени са свим ендогеним протеинима, наше откривање Дрп1 на местима фисије митохондрија је у условима стабилног стања, и сходно томе, не можемо да разликујемо регрутацију и дефект задржавања ензима изазваног СФН. Даље, још увек не можемо елиминисати могућност да СФН ацилује рецептор у митохондријима (Фис1 или Мфф) да би блокирао регрутацију Дрп1, сумњамо да је Дрп1 директно модификован. Дрп1 има девет цистеина, од којих се осам налази у средњем домену који је неопходан за олигомеризацију [3], а од којих се један налази у ГТПасе Еффецтор домену (ГЕД) на Ц-терминусу Дрп1. Директна ацилација било ког од ових цистеина може изазвати дефект активности у Дрп1 и стога лежи у основи ефекта СФН на динамику митохондрија. Нарочито, претходни рад сугерише да дефекти у олигомеризацији и каталитичкој активности могу поништити задржавање Дрп1 у митохондријама [52]. Цис644 у ГЕД домену је посебно атрактивна мета на основу претходног рада који показује да мутација овог цистеина фенокопира мутације које нарушавају активност Дрп1 ГТПазе [4] и да је овај специфични цистеин модификован помоћу тиол-реактивних електрофила [9]. Решење овог отвореног питања захтеваће валидацију масене спектрометрије. Укратко, идентификовали смо нову, цитопротективну функцију за клинички релевантно једињење СФН. Поред активирања главног антиоксидативног транскрипционог фактора Нрф2, СФН промовише митохондријалну и пероксизомалну фузију, а овај ефекат је независан од Нрф2. Механизам који лежи у основи овог феномена укључује смањење функције ГТПазе Дрп1, примарног посредника митохондријалне и пероксизомалне фисије. Главна последица митохондријалне фузије посредоване СФН је да ћелије постају отпорне на токсичне ефекте стауроспорина индуктора апоптозе. Ово додатно цитопротективно дејство СФН-а могло би бити од посебне клиничке користи у бројним неуродегенеративним болестима за које је старост водећи фактор ризика (нпр. Паркинсонова болест, Алцхајмерова болест, макуларна дегенерација повезана са старењем) пошто су ове болести повезане са апоптозом и смањене нивоа и/или дисрегулације Нрф2 [35], [36], [48].
Материјал и метод
Апоптосис Ассаис
Ћелије су засејане и трансфектоване сиРНА као што је назначено у наставку. Ћелије су претходно третиране са 50 уМ сулфорафана током 2 х да би се индуковала фузија митохондрија и затим су третиране са 1 уМ стауроспорином да би се индуковала апоптоза. У време жетве, медијум је сакупљен у појединачне епрувете и подвргнут високобрзинском центрифугирању до апоптотичких ћелија пелета. Ова ћелијска пелета је комбинована са адхерентним ћелијама и растворена у 2 пута концентрованом Лаеммли пуферу. Узорци су подвргнути анти-ПАРП вестерн блотингу.
ЦРИСПР/Цас9 Цонструцт Генератион
Да би се направио ЛентиЦРИСПР/еЦас9 1.1, ЛентиЦРИСПР в2 (аддгене #52961) је прво исечен са Аге1 и БамХ1. Следеће, СпЦас9 из еСпЦас9 1.1 (аддгене #71814) је ПЦР амплификован са Аге1 и БамХ1 превисима коришћењем следећих прајмера (Форвард АГЦГЦАЦЦГГТТЦТАГАГЦГЦТГЦЦАЦЦАТГГАЦТАТААГГАЦЦАЦГАЦ, Реверсе ААГЦГГАТЦЦЦГЦТТЦГТТГТТГТТГТТГТТГТТГТТГТТГТТГТТГТТГТГТГГТАЦЦГТТЦТАГГЦГЦТГЦЦАЦЦАТГГАЦТАТААГГАЦЦАЦГАЦ и Реверсе ААГЦГГАТЦЦЦГЦТТЦГТТГТТГТТГТТГТТГТТГ сгРНА секвенце су одређене коришћењем Бенцхлинг.цом. Параметри су постављени тако да циљају секвенцу кодирања са највишим резултатима на мети и најнижим резултатима ван циља. The following sequences (targeting sequence underlined, hs sgNFE2L2#1 sense CACCGCGACGGAAAGAGTATGAGC, antisense AAACGCTCATACTCTTTCCGTCGC; hs sgNFE2L2#2 sense CACCGGTTTCTGACTGGATGTGCT, antisense AAACAGCACATCCAGTCAGAAACC; hs sgNFE2L2#3 sense CACCGGAGTAGTTGGCAGATCCAC, antisense AAACGTGGATCTGCCAACTACTCC) were annealed and ligated into BsmB1 cut LentiCRISPR/eCas9 1.1. Лентивирусно инфициране РПЕ-1 ћелије су одабране са пуромицином и одржаване као здружена популација. Нокаут је потврђен имунофлуоресценцијом и вестерн блотингом.
Ћелијска култура и трансфекције
Људске пигментне епителне ћелије ретине трансформисане теломеразом (РПЕ-1) (АТЦЦ) узгајане су у Дулбеццо-овом модификованом медијуму орла (ДМЕМ) који садржи 1 г/Л глукозе допуњене пеницилином, стрептомицином, 1Кс коктелом неесенцијалних амино киселина (Лифе Тецхнологиес), и 10% феталног говеђег серума (Лифе Тецхнологиес). За сиРНА-трансфекције, 30,000 × 35,000 ћелија/мЛ је засејано преко ноћи. Ћелије су добиле 10 нМ сиРНА разблажену у ДМЕМ-у без серума и комбиновану са 0.3% реагенсом за трансфекцију интерферина (ПолиПлус). За сензибилизацију апоптозе, ћелије су примиле 1 нМ Бцл-КСЛ сиРНА. Ћелије су сакупљене 2 дана након трансфекције.
Хемикалије, антитела и сиРНА олиго
Антитела против ?-тубулина (ћелијска сигнализација), ?-тубулина (Сигма), Дрп1 (БД Биосциенцес), КЕАП1 (Протеинтецх), Ламин Б1 (Абцам), ПАРП (ћелијска сигнализација), ПМП70 (Абцам) и Том20 (БД Биосциенцес ) коришћени су у разблажењима 1:1000 за Вестерн блоттинг и за имунофлуоресценцију. Ин-хоусе, анти-Нрф2 зечје антитело је коришћено у 1:2000 за вестерн блоттинг [34], [59]. Сулфорафан (Сигма) и стауроспорин (Тоцрис) су коришћени при 50 уМ и 1 уМ респективно. сиРНА против Дрп1 (Дхармацон), Нрф2 (Дхармацон), КЕАП1 (ћелијска сигнализација) и Бцл-КСЛ (ћелијска сигнализација) су коришћене на 10 нМ осим ако није другачије назначено.
Имунофлуоресценција и ин виво обележавање
Ћелије засејане на стакленим поклопцима од 18 мм третиране су носачем или леком, фиксиране у 3.7% формалдехида и затим пермеабилизоване у 0.2% Тритон Кс-100/ПБС на леду 10 минута. Примарна антитела су инкубирана у 3% говеђем серумском албумину (БСА) у ПБС преко ноћи на 4 °Ц. После испирања ПБС, ћелије су инкубиране 1 х у коњугованим секундарним антителима Алека488- или Алека546- прикладним врстама (разблаженим 1:1000) и 0.1 уг/мЛ ДАПИ (Сигма) у 3% БСА/ПБС. Митохондрије су визуелизоване или анти-Том20 имунофлуоресценцијом или инкубацијом ћелија у 200 нМ МитоТрацкер Ред ЦМКСРос (Молецулар Пробес, Инц.) у ДМЕМ-у без серума током 30 минута на 37 °Ц пре фиксације.
Микроскопија и анализа слике
Узорци имунофлуоресценције су прегледани на ЛСМ710 конфокалном микроскопу (Царл Зеисс). Микрофотографије су снимљене коришћењем 63Кс или 100Кс објектива за урањање у уље, а слике су прилагођене и побољшане помоћу Адобе Пхотосхоп ЦС6. Анализа ко-локализације је изведена коришћењем Царл Зеисс ЛСМ710 функције ко-локализације са праговима који су ручно постављени док се не види идентитет узорака. Скала траке свуда, осим ако није другачије назначено, су 10 м. Морфологија митохондрија је процењена слепим бодовањем. Ако су митохондрије ћелије одржаване као вишеструке, округле, дискриминаторне тачке, ћелија је оцењена као „фисија“. Ако се појединачне митохондрије нису могле разликовати и цела митохондријска мрежа је изгледала континуирано, ћелија је оцењена као „фузија“. Све остале ћелије, укључујући оне са груписаним митохондријама, оцењене су као "средње".
Субцелулар Фрацтионатионс
РПЕ-1 ћелије су узгајане до конфлуенције. После испирања ПБС-ом, ћелије су подвргнуте центрифугирању на 600°г током 10 мин и ресуспендоване у 600 µЛ пуфера за изолацију (210 мМ манитол, 70 мМ сахароза, 5 мМ МОПС, 1 мМ ЕДТА пХ 7.4+1 мМ ПМСФ). Суспензија је лизирана 30 пута у Доунце хомогенизатору. Фракција хомогената је сачувана као "лизат целе ћелије". Остатак је подвргнут центрифугирању на 800°г током 10 минута да би се формирала језгра пелета. Супернатанти су подвргнути центрифугирању на 1500ºг током 10 минута да би се очистила преостала језгра и нелизоване ћелије. Овај супернатант је подвргнут центрифугирању на 15,000 ºг током 15 минута да би се митохондрије пелете. Супернатант је сачуван као "цитосолна фракција". Пелет је нежно испран са ПБС и ресуспендован у пуферу за изолацију. Концентрација протеина сваке фракције је мерена тестом бицинхонинске киселине (БЦА), а еквивалентне количине протеина су раздвојене помоћу СДС-ПАГЕ.
Вестерн блоттинг
Ћелије су испране у ПБС и растворене у 2 пута концентрованом Лаеммлијевом солубилизирајућем пуферу (100 мМ Трис [пХ 6.8], 2% СДС, 0.008% бромофенол плаво, 2% 2-меркаптоетанола, 26.3% глицерола И.О.0.001% ПиО). Лизати су кувани 5 минута пре стављања на натријум додецил сулфат (СДС) полиакриламид гелове. Протеини су пребачени на нитроцелулозне мембране и мембране су блокиране 1 х у 5% млека/ТБСТ. Примарна антитела су разблажена у 5% млека/ТБСТ и инкубирана са мрљом преко ноћи на 4 °Ц. Секундарна антитела коњугована са пероксидазом хрена (ХРП) разблажена су у 5% млека/ТБСТ. Блотови су обрађени са побољшаном хемилуминисценцијом, а дензитометријске квантификације су изведене коришћењем софтвера ИмагеЈ.

Сулфорафан је хемикалија из колекције изотиоцијаната органских сумпорних супстанци добијених из поврћа крсташа, укључујући броколи, купус, карфиол, кељ и огрлице, између осталог. Сулфорафан се производи када ензим мирозиназа трансформише глукорафанин, глукозинолат, у сулфорафан, такође познат као сулфорафан-глукозинолат. Клице броколија и карфиол имају највећу концентрацију глукорафанина или прекурсора сулфорафана. Истраживања су показала да сулфорафан побољшава антиоксидативне способности људског тела да спречи различите здравствене проблеме. Др Алек Јименез ДЦ, ЦЦСТ Инсигхт
Сулфорафан и његови ефекти на рак, морталитет, старење, мозак и понашање, болести срца и друго
Изотиоцијанати су нека од најважнијих биљних једињења која можете добити у исхрани. У овом видеу радим за њих најсвеобухватнији случај који је икада направљен. Кратак распон пажње? Пређите на своју омиљену тему кликом на једну од временских тачака у наставку. Комплетна временска линија испод.
Кључни делови:
- 00:01:14 - Рак и смртност
- 00:19:04 - Старење
- 00:26:30 - Мозак и понашање
- 00:38:06 - Коначни приказ
- 00:40:27 - Доза
Комплетна временска линија:
- 00:00:34 - Увођење сулфорафана, главни фокус видео снимка.
- 00:01:14 - Потрошња крстастих поврћа и смањење смртности од свих узрока.
- 00:02:12 - Ризик од рака простате.
- 00:02:23 - Ризик од рака бешике.
- 00:02:34 - Рак плућа код пушача ризикује.
- 00:02:48 - Ризик од рака дојке.
- 00:03:13 - Хипотетично: шта ако већ имате рак? (интервенцијски)
- 00:03:35 – Уверљиви механизам који покреће асоцијативне податке о раку и морталитету.
- 00:04:38 - Сулфорафан и рак.
- 00:05:32 – Докази на животињама показују снажан ефекат екстракта клице броколија на развој тумора бешике код пацова.
- 00:06:06 - Ефекат директне суплементације сулфорафана код пацијената са раком простате.
- 00:07:09 - Биоакумулација метаболита изотиоцијаната у стварном ткиву дојке.
- 00:08:32 - Инхибиција матичних ћелија рака дојке.
- 00:08:53 - Лекција из историје: брассицас је утврдио да има здравствена својства чак и у старом Риму.
- 00:09:16 - Сулфорафанова способност да појача излучивање канцерогена (бензен, акролеин).
- 00:09:51 - НРФ2 као генетски прекидач преко елемената антиоксидативног одговора.
- 00:10:10 - Како активација НРФ2 појачава излучивање канцерогена преко глутатиона-С-коњугата.
- 00:10:34 - Кељ у Бриселу повећава глутатион-С-трансферазу и смањује оштећење ДНК.
- 00:11:20 - Напитак од клице брокуле повећава излучивање бензела за 61%.
- 00:13:31 - Хомогенат клице брокуле повећава антиоксидативне ензиме у горњим дисајним путевима.
- 00:15:45 - Конзумација крстастих поврћа и смртност од срчаних болести.
- 00:16:55 - Прашак клице брокуле побољшава липиде у крви и укупан ризик од болести срца код дијабетичара типа 2.
- 00:19:04 – Почетак секције старења.
- 00:19:21 – Исхрана обогаћена сулфорафаном продужава животни век буба од 15 до 30% (у одређеним условима).
- 00:20:34 - Значај слабе упале за дуговечност.
- 00:22:05 - Чини се да крстасто поврће и прах клица брокуле смањују широк спектар маркера упале код људи.
- 00:23:40 - Осврт на видео запис: рак, делови за старење
- 00:24:14 - Студије на мишевима сугеришу да сулфорафан може побољшати адаптивну имунолошку функцију у старости.
- 00:25:18 – Сулфорафан је побољшао раст косе на мишјем моделу ћелавости. Слика на 00:26:10.
- 00:26:30 - Почетак одељења за мозак и понашање.
- 00:27:18 - Ефекат екстракта клице брокуле на аутизам.
- 00:27:48 - Ефекат глукорафанина на шизофренију.
- 00:28:17 - Почетак дискусије о депресији (вероватни механизам и студије).
- 00:31:21 – Студија на мишу користећи 10 различитих модела депресије изазване стресом показује да је сулфорафан сличан ефикасан као флуоксетин (прозак).
- 00:32:00 - Студија показује да је директно уношење глукорафанина код мишева слично ефикасно у спречавању депресије из модела стреса социјалног пораза.
- 00:33:01 - Почетак одељења за неуродегенерацију.
- 00:33:30 - Сулфорафан и Алцхајмерова болест.
- 00:33:44 - Сулфорафан и Паркинсонова болест.
- 00:33:51 - Сулфорафан и Хунгтингтонова болест.
- 00:34:13 - Сулфорафан повећава протеине топлотног шока.
- 00:34:43 - Почетак одељења са трауматском повредом мозга.
- 00:35:01 - Сулфорафан убризган непосредно након ТБИ побољшава меморију (студија миша).
- 00:35:55 - Сулфорафан и неуронска пластичност.
- 00:36:32 – Сулфорафан побољшава учење у моделу дијабетеса типа ИИ код мишева.
- 00:37:19 – Сулфорафан и Дуцхенне мишићна дистрофија.
- 00:37:44 - Инхибиција миостатина у мишићним сателитским ћелијама (ин витро).
- 00:38:06 - Касни видео-приказ: смртност и рак, оштећење ДНК, оксидативни стрес и упале, излучивање бензена, кардиоваскуларне болести, дијабетес типа ИИ, ефекти на мозак (депресија, аутизам, шизофренија, неуродегенерација), пут НРФ2.
- 00:40:27 - Размишљања о проналажењу дозе клица брокуле или сулфорафана.
- 00:41:01 - Анегдоте о ницању код куће.
- 00:43:14 - О температурама кувања и активности сулфорафана.
- 00:43:45 - Конверзија бактерија у цревима сулфорафана из глукорафанина.
- 00:44:24 - Додаци делују боље у комбинацији са активном мирозиназом из поврћа.
- 00:44:56 - Технике кувања и крстасто поврће.
- 00:46:06 - Изотиоцијанати као гоитрогени.
Признања
Сциенцедирецт.цом/сциенце/артицле/пии/С2213231716302750
Како се производи сулфорафан?
Загревање смањује активност протеина епитиоспецифика и повећава формирање сулфорафана у броколију
Апстрактан
Сулфорафан, изотиоцијанат из броколија, један је од најмоћнијих антиканцерогених средстава из хране. Ово једињење није присутно у нетакнутом поврћу, већ се формира од његовог прекурсора глукозинолата, глукорафанина, деловањем мирозиназе, ензима тиоглукозидазе, када се ткиво броколија дроби или жваће. Међутим, бројне студије су показале да је принос сулфорафана из глукорафанина низак и да је небиоактивни аналог нитрила, сулфорафан нитрил, примарни производ хидролизе када се биљно ткиво дроби на собној температури. Недавни докази сугеришу да се код Арабидопсис-а формирање нитрила из глукозинолата контролише протеином осетљивим на топлоту, епитиоспецифичним протеином (ЕСП), некаталитичким кофактором мирозиназе. Наши циљеви су били да испитамо ефекте загревања цветова и клица броколија на формирање сулфорафана и сулфорафан нитрила, да утврдимо да ли броколи садржи ЕСП активност, затим да повежемо промене зависне од топлоте у ЕСП активности, садржају сулфорафана и биоактивности, мерене индукцијом фаза ИИ детоксикациони ензим кинон редуктаза (КР) у ћелијској култури. Загревање свежих цветова броколија или клица броколија на 60 °Ц пре хомогенизације истовремено је повећало стварање сулфорафана и смањило стварање сулфорафан нитрила. Значајан губитак ЕСП активности је упоредо са смањењем формирања сулфорафан нитрила. Загревање на 70 °Ц и више смањило је формирање оба производа у цветовима броколија, али не и у клицама броколија. Индукција КР у ћелијама хепатома Хепа лцлц7 хепатома у култивацији миша је паралелно са повећањем формирања сулфорафана.

Претходно загревање цветова и клица броколија на 60 °Ц значајно је повећало формирање сулфорафана (СФ) катализовано мирозиназом у екстрактима биљног ткива након дробљења. Ово је било повезано са смањењем формирања сулфорафан нитрила (СФ нитрила) и активности епитиоспецифичног протеина (ЕСП).
Кључне речи: Броколи, Брассица олерацеа, Цруциферае, Рак, Антиканцероген, Сулфорафан, Сулфорафан нитрил, Епитхиоспецифиер протеин, Кинон редуктаза
У закључку, сулфорафан је фитокемикалија која се налази у броколију и другом поврћу крсташа. Неконтролисана количина оксиданата узрокована и унутрашњим и спољашњим факторима може изазвати оксидативни стрес у људском телу што на крају може довести до разних здравствених проблема. Сулфорафан може активирати производњу Нрф2, фактора транскрипције који помаже у регулисању заштитних антиоксидативних механизама који контролишу одговор ћелије на оксидансе. Обим наших информација је ограничен на киропрактику и здравствене проблеме кичме. Да бисте разговарали о овој теми, слободно питајте др Хименеза или нас контактирајте на�915-850-0900 .
Курирао др Алек Јименез
Наведено из: Сциенцедирецт.цом

Додатна тема: �Акутни бол у леђима
Бол у леђима�један од најчешћих узрока инвалидитета и пропуштених дана на послу широм света. Бол у леђима приписује другом најчешћем разлогу посета лекару, надмашују га само инфекције горњих дисајних путева. Отприлике 80 процената популације искусиће бол у леђима бар једном током свог живота. Кичма је сложена структура коју чине кости, зглобови, лигаменти и мишићи, између осталих меких ткива. Због тога, повреде и/или отежана стања, као што је�хернија дискова, на крају може довести до симптома болова у леђима. Спортске повреде или повреде у аутомобилским несрећама често су најчешћи узрок болова у леђима, али понекад најједноставнији покрети могу имати болне резултате. Срећом, алтернативне опције лечења, попут хиропрактичке неге, могу помоћи у ублажавању болова у леђима употребом кичмених подешавања и ручних манипулација, на крају побољшавајући ублажавање болова.

ЕКСТРА ЕКСТРА | ВАЖНА ТЕМА: Препоручени Ел Пасо, ТКС Цхиропрацтор
***
Информације овде о „Шта је сулфорафан?" није намењен да замени однос један на један са квалификованим здравственим радником или лиценцираним лекаром и није медицински савет. Подстичемо вас да доносите одлуке о здравственој заштити на основу вашег истраживања и партнерства са квалификованим здравственим радником.
Информације о блогу и дискусије о обиму
Наш обим информација је ограничен на киропрактику, мускулоскелетну, физикалне лекове, веллнесс, доприносећи етиолошкој висцеросоматски поремећаји унутар клиничких презентација, повезане клиничке динамике соматовисцералног рефлекса, комплекса сублуксације, осетљивих здравствених проблема и/или чланака, тема и дискусија функционалне медицине.
Пружамо и представљамо клиничка сарадња са специјалистима из разних дисциплина. Сваки специјалиста се руководи својим професионалним обимом праксе и јурисдикцијом лиценцирања. Користимо функционалне здравствене и веллнесс протоколе за лечење и подршку нези повреда или поремећаја мишићно-скелетног система.
Наши видео снимци, постови, теме, теме и увиди покривају клиничка питања, проблеме и теме које се односе на и директно или индиректно подржавају наш клинички обим праксе.*
Наша канцеларија је разумно покушала да обезбеди цитате у прилог и идентификовала је релевантну истраживачку студију или студије које подржавају наше објаве. На захтев пружамо копије пратећих истраживачких студија доступне регулаторним одборима и јавности.
Разумемо да покривамо питања која захтевају додатно објашњење како то може помоћи у одређеном плану неге или протоколу лечења; зато, да бисте даље разговарали о горњој теми, слободно питајте Др Алек Јименез, ДЦ, или нас контактирајте 915-850-0900.
Овде смо да помогнемо вама и вашој породици.
Благослови
Др. Алек Јименез ДЦ, МСАЦП, РН*, ЦЦСТ, ИФМЦП*, ЦИФМ*, АТН*
e-маил: цоацх@елпасофунцтионалмедицине.цом
Лиценцирани као доктор киропрактике (ДЦ) у Тексас & Нови Мексико*
Тексас ДЦ лиценца бр. ТКСКСНУМКС, Нев Мекицо ДЦ Лиценца # НМ-ДЦ2182
Лиценцирана као медицинска сестра (РН*) in Флорида
Флорида лиценца РН лиценца # РНКСНУМКС (Контролни бр. 3558029)
Компактни статус: Вишедржавна лиценца: Овлашћени за праксу у КСНУМКС државе*
Др Алек Јименез ДЦ, МСАЦП, РН* ЦИФМ*, ИФМЦП*, АТН*, ЦЦСТ
Моја дигитална визит карта






