Кетонска тела ствара јетра и користе се као извор енергије када глукоза није лако доступна у људском телу. Два главна кетонска тела су ацетоацетат (АцАц) и 3-бета-хидроксибутират (3ХБ), док је ацетон треће и најмање заступљено кетонско тело. Кетони су увек присутни у крви и њихов ниво се повећава током гладовања и дужег вежбања.�Кетогенесис је биохемијски процес којим организми производе кетонска тела разградњом масних киселина и кетогених аминокиселина.
Кетонска тела се углавном генеришу у митохондрији ћелија јетре. Кетогенеза се јавља када је ниво глукозе у крви низак, посебно након што су исцрпљене друге ћелијске залихе угљених хидрата, као што је гликоген. Овај механизам се такође може јавити када нема довољно инсулина. Производња кетонских тела се на крају покреће да би се учинила доступна енергија која се складишти у људском телу као масне киселине. Кетогенеза се јавља у митохондријима где је независно регулисана.
Садржај
Апстрактан
Метаболизам кетонских тела је централни чвор у физиолошкој хомеостази. У овом прегледу разматрамо како кетони служе дискретним метаболичким улогама финог подешавања које оптимизују перформансе органа и организма у различитим остацима хранљивих материја и штите од запаљења и повреда у вишеструким системима органа. Традиционално посматрани као метаболички супстрати укључени само у ограничењу угљених хидрата, недавна запажања наглашавају важност кетонских тела као виталних метаболичких и сигналних медијатора када су угљени хидрати у изобиљу. Допуњујући репертоар познатих терапијских опција за болести нервног система, појавиле су се потенцијалне улоге кетонских тела у раку, као и интригантне заштитне улоге у срцу и јетри, отварајући терапијске опције у болестима повезаних са гојазношћу и кардиоваскуларним болестима. Разматрају се контроверзе у метаболизму кетона и сигнализацији како би се помирила класична догма са савременим запажањима.
увод
Кетонска тела су витални алтернативни извор метаболичког горива за све домене живота, еукарију, бактерије и археје (Анеја ет ал., 2002; Цахилл ГФ Јр, 2006; Крисхнакумар ет ал., 2008). Метаболизам кетонског тела код људи је искоришћен да подстакне мозак током епизодних периода недостатка хранљивих материја. Кетонска тела су испреплетена са кључним метаболичким путевима сисара као што су ?-оксидација (ФАО), циклус трикарбоксилне киселине (ТЦА), глуконеогенеза, де ново липогенеза (ДНЛ) и биосинтеза стерола. Код сисара, кетонска тела се производе претежно у јетри из ацетил-ЦоА добијеног из ФАО и транспортују се у екстрахепатична ткива ради терминалне оксидације. Ова физиологија пружа алтернативно гориво које је појачано релативно кратким периодима поста, што повећава доступност масних киселина и смањује доступност угљених хидрата (Цахилл ГФ Јр, 2006; МцГарри и Фостер, 1980; Робинсон и Виллиамсон, 1980). Оксидација кетонских тела постаје значајан допринос укупном енергетском метаболизму сисара у екстрахепатичним ткивима у безброј физиолошких стања, укључујући гладовање, гладовање, неонатални период, после вежбања, трудноћу и придржавање дијете са мало угљених хидрата. Укупне концентрације кетонских тела у циркулацији код здравих одраслих људи обично показују циркадијалне осцилације између приближно 100 × 250 �М, порасту на ~1 мМ након дужег вежбања или 24 сата гладовања и могу да се акумулирају до чак 20 мМ у патолошким стањима као што је дијабетичка кетоацидоза ( Цахилл ГФ Јр, 2006; Јохнсон ет ал., 1969б; Коеслаг ет ал., 1980; Робинсон и Виллиамсон, 1980; Вилденхофф ет ал., 1974). Људска јетра производи до 300 г кетонских тела дневно (Балассе и Фери, 1989), која доприносе између 5% укупне потрошње енергије у стању нахрањености, гладовања и гладовања (Балассе ет ал., 20; Цок ет ал. ал., 1978).
Недавне студије сада истичу императивну улогу кетонских тела у метаболизму ћелија сисара, хомеостази и сигнализацији у широком спектру физиолошких и патолошких стања. Осим што служе као енергетско гориво за екстрахепатична ткива попут мозга, срца или скелетних мишића, кетонска тела играју кључну улогу као сигнални медијатори, покретачи протеинске пост-транслационе модификације (ПТМ) и модулатори упале и оксидативног стреса. У овом прегледу дајемо и класичне и модерне погледе на плеиотропне улоге кетонских тела и њихов метаболизам.
Преглед метаболизма кетонског тела
Брзина хепатичне кетогенезе је регулисана оркестрираним низом физиолошких и биохемијских трансформација масти. Примарни регулатори укључују липолизу масних киселина из триацилглицерола, транспорт до и преко плазма мембране хепатоцита, транспорт у митохондрије преко карнитин палмитоилтрансферазе 1 (ЦПТ1), ?-оксидациону спиралу, активност ТЦА циклуса и средње концентрације, потенцијал редокс регулатора и хормонални регулаторни потенцијал и хормонални регулатори. од ових процеса, претежно глукагон и инсулин [прегледано у (Ариас ет ал., 1995; Аите ет ал., 1993; Ехара ет ал., 2015; Ферре ет ал., 1983; Кахн ет ал., 2005; МцГарри и Фостер , 1980; Виллиамсон ет ал., 1969)]. Класично, кетогенеза се посматра као пут преливања, у којем ацетил-ЦоА изведен из α-оксидације премашује активност цитрат синтазе и/или доступност оксалоацетата за кондензацију да би се формирао цитрат. Интермедијери са три угљеника показују анти-кетогено деловање, вероватно због њихове способности да прошире скуп оксалоацетата за потрошњу ацетил-ЦоА, али концентрација ацетил-ЦоА у јетри сама не одређује кетогену брзину (Фостер, 1967; Рават и Менахан, 1975; Виллиамсон ет ал., 1969). Регулација кетогенезе помоћу хормоналних, транскрипционих и посттранслационих догађаја заједно подржава идеју да молекуларни механизми који фино подешавају кетогенезу остају непотпуно схваћени (видети Регулацију ХМГЦС2 и СЦОТ/ОКСЦТ1).
Кетогенеза се јавља првенствено у јетри митохондријског матрикса брзином пропорционалном укупној оксидацији масти. После транспорта ацилних ланаца кроз митохондријске мембране и а-оксидације, митохондријски изоформ 3-хидроксиметилглутарил-ЦоА синтазе (ХМГЦС2) катализује судбину која врши кондензацију ацетоацетил-ЦоА (АцАц-ЦоА) и ацетил-ЦоА за стварање ХМГ-ЦоА (Слика 1А). ХМГ-ЦоА лиаза (ХМГЦЛ) цепа ХМГ-ЦоА да би се ослободио ацетил-ЦоА и ацетоацетат (АцАц), а овај последњи се редукује на д -? - хидроксибутират (д-? ОХБ) митохондријским д-? ОХБ дехидрогеназом (д-? ОХБ) зависним од дс? БДХ1) у НАД + / НАДХ спрегнутој реакцији скоро равнотеже (Боцк и Флеисцхер, 1975; ЛЕХНИНГЕР и сар., 1960). Константа равнотеже БДХ1 фаворизује производњу д-? ОХБ, али је однос АцАц / д-? ОХБ кетонских тела директно пропорционалан митохондријском односу НАД + / НАДХ, а самим тим и активност БДХ1 оксидоредуктазе модулира редокс потенцијал митохондрија (Кребс и сар., 1969; Виллиамсон и сар., 1967). АцАц такође може спонтано да се декарбоксилира у ацетон (Педерсен, 1929), извор слатког мириса код људи који пате од кетоацидозе (тј. Укупна серумска кетонска тела> ~ 7 мМ; АцАц пКа 3.6,? ОХБ пКа 4.7). Механизми путем којих се кетонска тела транспортују кроз унутрашњу мембрану митохондрија нису познати, али АцАц / д-? ОХБ се ослобађају из ћелија путем монокарбоксилатних транспортера (код сисара, МЦТ 1 и 2, такође познати као растворени носачи 16А чланови породице 1 и 7) и транспортовани у циркулацији у екстрахепатична ткива ради терминалне оксидације (Цоттер и сар., 2011; Халестрап и Вилсон, 2012; Халестрап, 2012; Хуго и сар., 2012). Концентрације кетонских тела у циркулацији су веће од оних у екстрахепатичним ткивима (Харрисон и Лонг, 1940) што указује да се кетонска тела преносе низ градијент концентрације. Мутације губитка функције у МЦТ1 повезане су са спонтаним нападима кетоацидозе, што указује на критичну улогу у увозу кетонског тела.
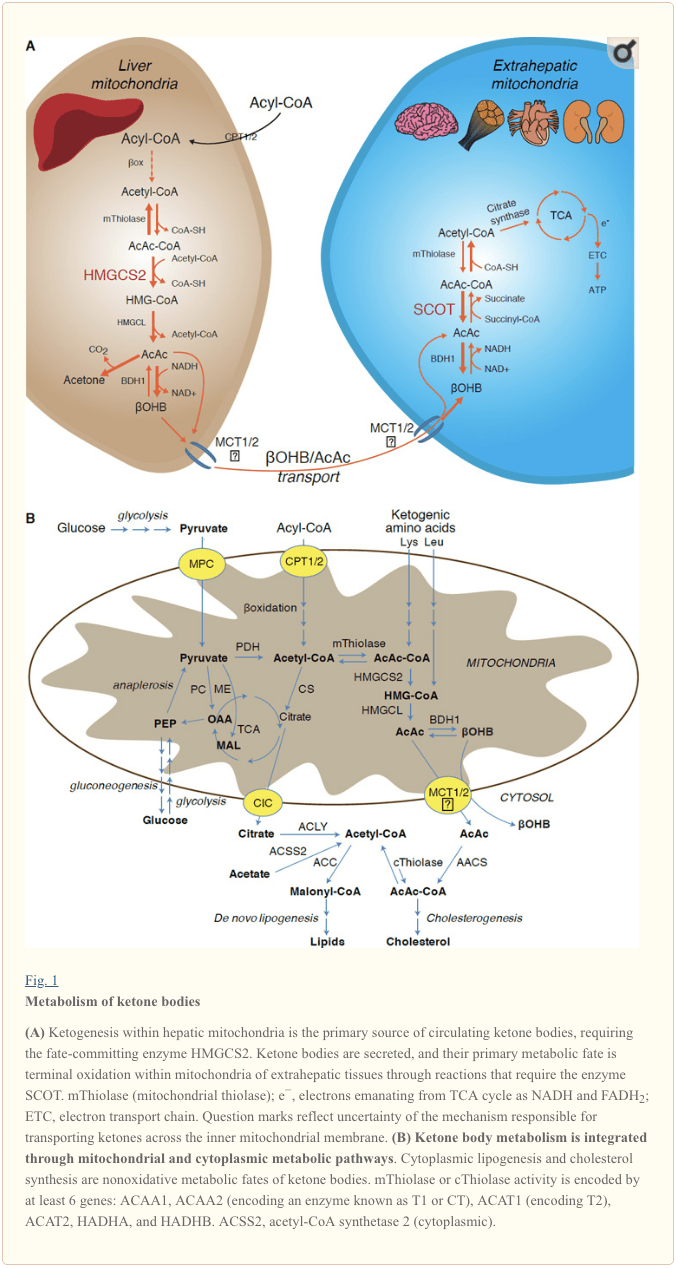
� Са изузетком потенцијалног преусмеравања кетонских тела у неоксидативне судбине (погледајте Неоксидативне метаболичке судбине кетонских тела), хепатоцити немају способност да метаболишу кетонска тела која производе. Кетонска тела синтетизована де ново у јетри се (и) катаболишу у митохондријама екстрахепатичног ткива до ацетил-ЦоА, који је доступан ТЦА циклусу за терминалну оксидацију (слика 1А), (ии) преусмерава се на путеве липогенезе или синтезе стерола ( Слика 1Б), или (иии) излучује се урином. Као алтернативно енергетско гориво, кетонска тела се страствено оксидују у срцу, скелетним мишићима и мозгу (Балассе и Фери, 1989; Бентоуркиа ет ал., 2009; Овен ет ал., 1967; Реицхард ет ал., 1974; Султан, 1988 ). Екстрахепатични митохондријски БДХ1 катализује прву реакцију оксидације ?ОХБ, претварајући је у позадински АцАц (ЛЕХНИНГЕР ет ал., 1960; Сандерманн ет ал., 1986). Цитоплазматска д-?ОХБ-дехидрогеназа (БДХ2) са само 20% идентичности секвенце са БДХ1 има висок Км за кетонска тела, а такође игра улогу у хомеостази гвожђа (Давулури ет ал., 2016; Гуо ет ал., 2006) . У екстрахепатичном митохондријском матриксу, АцАц се активира у АцАц-ЦоА путем размене ЦоА-остатка из сукцинил-ЦоА у реакцији коју катализује јединствена ЦоА трансфераза сисара, сукцинил-ЦоА:3-оксокиселина-ЦоА трансфераза (СЦОТ, ЦоА трансфераза; кодиран са ОКСЦТ1), кроз реакцију скоро равнотеже. Слободна енергија ослобођена хидролизом АцАц-ЦоА је већа од енергије сукцинил-ЦоА, што погодује формирању АцАц. Тако се оксидативни ток кетонских тела јавља услед дејства масе: обилно снабдевање АцАц и брза потрошња ацетил-ЦоА кроз цитрат синтазу фаворизује стварање АцАц-ЦоА (+ сукцината) од стране СЦОТ. Нарочито, за разлику од глукозе (хексокиназе) и масних киселина (ацил-ЦоА синтетаза), активација кетонских тела (СЦОТ) у оксидабилни облик не захтева улагање АТП-а. Реверзибилна реакција АцАц-ЦоА тиолазе [коју катализира било која од четири митохондријалне тиолазе које кодирају било АЦАА2 (кодирајући ензим познат као Т1 или ЦТ), АЦАТ1 (кодирање Т2), ХАДХА или ХАДХБ] даје два молекула ацетил-ЦоА који улазе у ТЦА циклус (Херсх и Јенцкс, 1967; Стерн ет ал., 1956; Виллиамсон ет ал., 1971). Током кетотичких стања (тј., укупни кетони у серуму > 500 �М), кетонска тела значајно доприносе потрошњи енергије – и брзо се користе у ткивима све док не дође до преузимања или засићења оксидацијом (Балассе ет ал., 1978; Балассе и Фери, 1989. Едмонд ет ал., 1987). Веома мали део кетонских тела добијених из јетре може се лако измерити у урину, а стопе коришћења и реапсорпције у бубрезима су пропорционалне концентрацији у циркулацији (Голдстеин, 1987; Робинсон и Виллиамсон, 1980). Током високо кетотичких стања (> 1 мМ у плазми), кетонурија служи као семи-квантитативни репортер кетозе, иако већина клиничких анализа кетонских тела у урину открива АцАц, али не и ?ОХБ (Клоцкер ет ал., 2013).
Кетогени супстрати и њихов утицај на метаболизам хепатоцита
Кетогени супстрати укључују масне киселине и аминокиселине (слика 1Б). Катаболизам аминокиселина, посебно леуцина, генерише око 4% кетонских тела у пост-апсорпционом стању (Тхомас ет ал., 1982). Стога базен супстрата ацетил-ЦоА за генерисање кетонских тела углавном потиче од масних киселина, јер током стања смањене залихе угљених хидрата, пируват улази у хепатички ТЦА циклус првенствено анаплерозом, тј. Карбоксилацијом зависном од АТП-а у оксалоацетат (ОАА) или у малат (МАЛ), а не оксидативна декарбоксилација у ацетил-ЦоА (Јеоунг и сар., 2012; Магнуссон и сар., 1991; Мерритт и сар., 2011). У јетри, глукоза и пируват занемарљиво доприносе кетогенези, чак и када је декарбоксилација пирувата у ацетил-ЦоА максимална (Јеоунг ет ал., 2012).
Ацетил-ЦоА преузима неколико улога интегралних за интермедијарни метаболизам јетре, изван генерације АТП путем терминалне оксидације (такође видети Интеграција метаболизма кетонског тела, пост-транслационе модификације и физиологија ћелија). Ацетил-ЦоА алостерично активира (и) пируват карбоксилазу (ПЦ), активирајући тиме метаболички контролни механизам који повећава анаплеротични улазак метаболита у ТЦА циклус (Овен и сар., 2002; Сцруттон и Уттер, 1967) и (ии) пируват дехидрогеназа. киназе, која фосфорилира и инхибира пируват дехидрогеназу (ПДХ) (Цоопер и сар., 1975), чиме додатно побољшава проток пирувата у ТЦА циклус путем анаплерозе. Даље, цитоплазматски ацетил-ЦоА, чији је базен повећан механизмима који претварају митохондријски ацетил-ЦоА у преносиве метаболите, инхибира оксидацију масних киселина: ацетил-ЦоА карбоксилаза (АЦЦ) катализује конверзију ацетил-ЦоА у малонил-ЦоА, липогени супстрат и алостерични инхибитор митохондријског ЦПТ1 [прегледан у (Кахн и сар., 2005; МцГарри и Фостер, 1980)]. Дакле, митохондријски ацетил-ЦоА базен регулише и регулише се путем преливања кетогенезе, који оркестрира кључне аспекте хепатичног посредничког метаболизма.
Неоксидативне метаболичке судбине кетонских тела
Преовлађујућа судбина кетона добијених из јетре је екстрахепатична оксидација зависна од СЦОТ-а. Међутим, АцАц се може извозити из митохондрија и користити у анаболичким путевима путем конверзије у АцАц-ЦоА помоћу АТП-зависне реакције катализоване цитоплазматском ацетоацетил-ЦоА синтетазом (ААЦС, слика 1Б). Овај пут је активан током развоја мозга иу млечној жлезди у лактацији (Моррис, 2005; Робинсон и Виллиамсон, 1978; Охгами ет ал., 2003). ААЦС је такође високо изражен у масном ткиву и активираним остеокластима (Агуило ет ал., 2010; Иамасаки ет ал., 2016). Цитоплазматски АцАц-ЦоА може бити или усмерен цитосолним ХМГЦС1 ка биосинтези стерола, или цепан било којом од две цитоплазматске тиолазе у ацетил-ЦоА (АЦАА1 и АЦАТ2), карбоксилиран у малонил-ЦоА, и допринети синтези масних киселина (гстром и ББер). сар., 1984; Едмонд, 1974; Ендеманн и сар., 1982; Геелен и сар., 1983; Веббер и Едмонд, 1977).
Док физиолошки значај тек треба да се утврди, кетони могу послужити као анаболички супстрати чак и у јетри. У вештачким експерименталним контекстима, АцАц може допринети чак половини новосинтетисаног липида и до 75% новог синтетизованог холестерола (Ендеманн ет ал., 1982; Геелен ет ал., 1983; Фреед ет ал., 1988). Пошто АцАц потиче од непотпуне оксидације масти у јетри, способност АцАц да допринесе липогенези ин виво би имплицирала бескорисно кружење јетре, где се кетони добијени из масти могу користити за производњу липида, идеја чији физиолошки значај захтева експерименталну валидацију, али може послужити адаптивне или маладаптивне улоге (Солинас ет ал., 2015). АцАц ентузијастично обезбеђује холестерогенезу, са ниским ААЦС Км-АцАц (~50 µМ) који фаворизује активацију АцАц чак иу стању храњења (Бергстром ет ал., 1984). Динамичка улога метаболизма цитоплазматских кетона је сугерисана у примарним мишјим ембрионалним неуронима и у адипоцитима изведеним из 3Т3-Л1, пошто је нокдаун ААЦС нарушио диференцијацију сваког типа ћелије (Хасегава ет ал., 2012а; Хасегава ет ал., ). Обарање ААЦС код мишева ин виво смањило је холестерол у серуму (Хасегава ет ал., 2012ц). СРЕБП-2012, главни регулатор транскрипције биосинтезе холестерола, и рецептор активиран пролифератором пероксизома (ППАР)-? су ААЦС активатори транскрипције и регулишу његову транскрипцију током развоја неурита и у јетри (Агуило ет ал., 2; Хасегава ет ал., 2010ц). Узети заједно, метаболизам цитоплазматских кетонских тела може бити важан у одабраним стањима или природним историјама болести, али је неадекватан за одлагање кетонских тела добијених из јетре, пошто се масивна хиперкетонемија јавља у окружењу селективног оштећења примарне оксидативне судбине услед губитка мутација функције. у СЦОТ (Берри ет ал., 2012; Цоттер ет ал., 2001).
Регулација ХМГЦС2 и СЦОТ / ОКСЦТ1
Дивергенција митохондрија од гена који кодира цитосолни ХМГЦС десила се рано у еволуцији кичмењака због потребе да се подржи хепатична кетогенеза код врста са већим односом тежине мозга и тела (Боукафтане ет ал., 1994; Цуннане и Цравфорд, 2003). Природне мутације ХМГЦС2 са губитком функције код људи изазивају нападе хипокетотичке хипогликемије (Питт ет ал., 2015; Тхомпсон ет ал., 1997). Робусна експресија ХМГЦС2 је ограничена на хепатоците и епител дебелог црева, а његова експресија и ензимска активност су координисани кроз различите механизме (Масцаро ет ал., 1995; МцГарри и Фостер, 1980; Робинсон и Виллиамсон, 1980). Док пуни опсег физиолошких стања која утичу на ХМГЦС2 захтева даље разјашњење, његова експресија и/или активност је регулисана током раног постнаталног периода, старења, дијабетеса, гладовања или узимања кетогене дијете (Балассе и Фери, 1989; Цахилл ГФ Јр, 2006 ; Гирард и сар., 1992; Хегардт, 1999; Сатапати и сар., 2012; Сенгупта и сар., 2010). Код фетуса, метилација 5� бочног региона Хмгцс2 гена у обрнутој је корелацији са његовом транскрипцијом и делимично је обрнуто након рођења (Ариас ет ал., 1995; Аите ет ал., 1993; Ехара ет ал., 2015; Ферре ет ал. ., 1983). Слично, хепатички Бдх1 показује развојни образац експресије, који се повећава од рођења до одбијања, а такође је индукован кетогеном исхраном на начин зависан од фактора раста фибробласта (ФГФ)-21 (Бадман ет ал., 2007; Зханг ет ал., 1989. ). Кетогенеза код сисара веома реагује и на инсулин и на глукагон, при чему се потискује и стимулише (МцГарри и Фостер, 1977). Инсулин потискује липолизу масног ткива, чиме лишава кетогенезу њеног супстрата, док глукагон повећава кетогени флукс директним дејством на јетру (Хегардт, 1999). Транскрипцију Хмгцс2 стимулише транскрипциони фактор форкхеад ФОКСА2, који је инхибиран преко инсулин-фосфатидилинозитол-3-киназе/Акт, а индукује се сигнализацијом глукагон-цАМП-п300 (Ариас ет ал., 1995; Хегардт, 1999; Куант, 1990). , 1993; Тхумелин ет ал., 2013; вон Меиенн ет ал., 2004; Волфрум ет ал., 2003; Волфрум ет ал., XNUMX). ППАР? (Родригуез ет ал., 1994) заједно са својом метом, ФГФ21 (Бадман ет ал., 2007) такође индукује транскрипцију Хмгцс2 у јетри током гладовања или примене кетогене дијете (Бадман ет ал., 2007; Инагаки ет ал., 2007). ). Индукција ППАР? може да се деси пре преласка са феталне на неонаталну физиологију, док активација ФГФ21 може бити фаворизована у раном неонаталном периоду преко ?ОХБ посредоване инхибиције хистон деацетилазе (ХДАЦ)-3 (Рандо ет ал., 2016). мТОРЦ1 (циља комплекса рапамицина 1) зависна од инхибиције ППАР? транскрипциона активност је такође кључни регулатор експресије гена Хмгцс2 (Сенгупта ет ал., 2010), а ПЕР2 јетре, главни циркадијални осцилатор, индиректно регулише експресију Хмгцс2 (Цхаван ет ал., 2016). Недавна запажања показују да интерлеукин-6 изазван екстрахепатичним тумором оштећује кетогенезу преко ППАР-а? сузбијање (Флинт ет ал., 2016).
Активност ензима ХМГЦС2 регулише се кроз више ПТМ-ова. ХМГЦС2 серинска фосфорилација појачала је своју активност ин витро (Гримсруд и сар., 2012). Активност ХМГЦС2 је алостерички инхибирана сукцинил-ЦоА и сукцинилацијом остатака лизина (Ариас и сар., 1995; Хегардт, 1999; Лове и Туббс, 1985; Куант и сар., 1990; Рардин и сар., 2013; Реед и сар., 1975; Тхумелин и сар., 1993). Сукцинилација остатака лизина ХМГЦС2, ХМГЦЛ и БДХ1 у митохондријима јетре су циљеви НАД + зависне деацилазе сиртуин 5 (СИРТ5) (Рардин ет ал., 2013). Активност ХМГЦС2 је такође појачана деацетилацијом лизина СИРТ3, а могуће је да преслушавање између ацетилације и сукцинилације регулише активност ХМГЦС2 (Рардин и сар., 2013; Схимазу и сар., 2013). Упркос способности ових ПТМ-а да регулишу ХМГЦС2 Км и Вмак, флуктуације ових ПТМ-а још увек нису пажљиво мапиране и нису потврђене као механички покретачи кетогенезе ин виво.
СЦОТ се експримује у свим ћелијама сисара које садрже митохондрије, осим хепатоцита. Важност СЦОТ активности и кетолизе демонстрирана је код СЦОТ-КО мишева, који су показали уједначену смртност због хиперкетонемијске хипогликемије у року од 48 сати након рођења (Цоттер ет ал., 2011). Ткиво-специфичан губитак СЦОТ-а у неуронима или скелетним миоцитима изазива метаболичке абнормалности током гладовања, али није смртоносан (Цоттер ет ал., 2013б). Код људи, недостатак СЦОТ се манифестује рано у животу тешком кетоацидозом, изазивајући летаргију, повраћање и кому (Берри ет ал., 2001; Фукао ет ал., 2000; Кассовска-Братинова ет ал., 1996; Ниезен-Конинг ет ал. , 1997; Саудубраи ет ал., 1987; Снидерман ет ал., 1998; Тилдон и Цорнблатх, 1972). Релативно мало се зна на ћелијском нивоу о регулаторима експресије СЦОТ гена и протеина. Експресија Окцт1 мРНА и СЦОТ протеин и активност су смањени у кетотичким стањима, вероватно кроз механизме зависне од ППАР (Фенселау и Валлис, 1974; Фенселау и Валлис, 1976; Гринблат ет ал., 1986; Окуда ет ал., 1991; Турко ет ал. ., 2001; Вентз ет ал., 2010). Код дијабетичке кетоацидозе, неусклађеност између хепатичке кетогенезе и екстрахепатичке оксидације се погоршава оштећењем СЦОТ активности. Прекомерна експресија инсулин-независног транспортера глукозе (ГЛУТ1/СЛЦ2А1) у кардиомиоцитима такође инхибира експресију гена Окцт1 и смањује терминалну оксидацију кетона у не-кетотичком стању (Иан ет ал., 2009). У јетри, обиље мРНА Окцт1 је потиснуто микроРНА-122 и метилацијом хистона Х3К27ме3 који су евидентни током преласка из феталног у неонатални период (Тхоррез ет ал., 2011). Међутим, супресија хепатичне експресије Окцт1 у постнаталном периоду првенствено се може приписати евакуацији хематопоетских прогенитора који експримирају Окцт1 из јетре, а не губитку раније постојеће експресије Окцт1 у терминално диференцираним хепатоцитима. У ствари, експресија Окцт1 мРНА и СЦОТ протеина у диференцираним хепатоцитима је изузетно ниска (Ории ет ал., 2008).
СЦОТ је такође регулисан ПТМ-овима. Ензим је хипер-ацетилован у мозгу СИРТ3 КО мишева, који такође показују смањену производњу ацетил-ЦоА зависне од АцАц (Диттенхафер-Реед ет ал., 2015). Неензимска нитрација тирозинских остатака СЦОТ-а такође слаби његову активност, што је пријављено у срцима различитих модела дијабетичких мишева (Марцондес ет ал., 2001; Турко ет ал., 2001; Ванг ет ал., 2010а). Насупрот томе, нитрација остатка триптофана повећава активност СЦОТ (Бр�г�ре ет ал., 2010; Ребрин ет ал., 2007). Молекуларни механизми нитрације или денитрације специфичне за остатке који су дизајнирани да модулишу активност СЦОТ могу постојати и захтевају разјашњење.
Контроверзе у екстрахепатичној кетогенези
Код сисара је примарни кетогени орган јетра, а само хепатоцити и епителне ћелије црева обилно експримирају митохондријску изоформу ХМГЦС2 (Цоттер ет ал., 2013а; Цоттер ет ал., 2014; МцГарри и Фостер, 1980; Робинсон1980) . Анаеробна бактеријска ферментација комплексних полисахарида даје бутират, који апсорбују колоноцити код сисара за терминалну оксидацију или кетогенезу (Цхербуи ет ал., 1995), што може играти улогу у диференцијацији колоноцита (Ванг ет ал., 2016). Изузимајући епителне ћелије црева и хепатоците, ХМГЦС2 је скоро одсутан у скоро свим другим ћелијама сисара, али изгледи за екстрахепатичну кетогенезу су повећани у ћелијама тумора, астроцитима централног нервног система, бубрезима, панкреасу ? ћелије, пигментни епител ретине (РПЕ), па чак и у скелетним мишићима (Адијанто ет ал., 2014; Авогаро ет ал., 1992; Ел Аззоуни ет ал., 2016; Грабацка ет ал., 2016; Канг ет ал., 2015 ; Ле Фолл ет ал., 2014; Нонака ет ал., 2016; Такаги ет ал., 2016а; Тхевенет ет ал., 2016; Зханг ет ал., 2011). Ектопични ХМГЦС2 је примећен у ткивима којима недостаје нето кетогени капацитет (Цоок ет ал., 2016; Вентз ет ал., 2010), а ХМГЦС2 испољава проспективне кетогенезе независне 'моонлигхтинг' активности, укључујући унутар ћелијског језгра (Цхен ет ал. , 2016; Костиук и сар., 2010; Меертенс и сар., 1998).
Било које екстрахепатично ткиво које оксидира кетонска тела такође има потенцијал да акумулира кетонска тела помоћу механизама независних од ХМГЦС2 (слика 2А). Међутим, не постоји екстрахепатично ткиво у којем стабилна концентрација кетонског тела прелази ону у циркулацији (Цоттер и сар., 2011; Цоттер и сар., 2013б; Харрисон и Лонг, 1940), што подвлачи да се кетонска тела преносе низ градијент концентрације преко МЦТ1 / 2-зависних механизама. Један механизам очигледне екстрахепатичне кетогенезе може заправо одражавати релативно оштећење оксидације кетона. Додатна потенцијална објашњења спадају у подручје формирања кетонског тела. Прво, де ново кетогенеза може се јавити реверзибилном ензимском активношћу тиолазе и СЦОТ (Веидеманн и Кребс, 1969). Када је концентрација ацетил-ЦоА релативно висока, реакције нормално одговорне за оксидацију АцАц делују у обрнутом смеру (ГОЛДМАН, 1954). Други механизам се дешава када се интермедијери изведени из а-оксидације акумулирају уским грлом у ТЦА циклусу, АцАц-ЦоА се претвара у л-? ОХБ-ЦоА реакцијом која је катализована митохондријском 3-хидроксиацил-ЦоА дехидрогеназом, а даље 3-хидроксибутирил ЦоА деацилазе до 1980-ОХБ, која се не разликује масном спектрометријом или резонантном спектроскопијом од физиолошког енантиомера д-ОХБ (Реед и Озанд, 2011). л-? ОХБ се може хроматографски или ензиматски разликовати од д-? ОХБ и присутан је у екстрахепатичним ткивима, али не и у јетри или крви (Хсу ет ал., 1984). Кетогенеза јетре производи само д-ОХБ, једини енантиомер који је супстрат БДХ (Ито и сар., 1987; Линцолн и сар., 1980; Реед и Озанд, 1982; Сцофиелд и сар., 1982; Сцофиелд и сар., 2). Трећи механизам независан од ХМГЦС1990 генерише д-? ОХБ катаболизмом аминокиселина, посебно оним леуцина и лизина. Четврти механизам је очигледан само зато што је резултат артефакта за обележавање и због тога се назива псеудокетогенезом. Овај феномен се може приписати реверзибилности СЦОТ и реакција тиолазе и може проузроковати прецењивање обрта кетонског тела услед изотопског разблаживања кетонског следника у екстрахепатичном ткиву (Дес Росиерс и сар., 1988; Финк и сар., 1990) . Без обзира на то, псеудокетогенеза може бити занемарљива у већини контекста (Баилеи и сар., 1978; Келлер и сар., 2). Шема (слика XNUMXА) указује на користан приступ који треба применити узимајући у обзир повишену концентрацију кетона у стационарном стању.
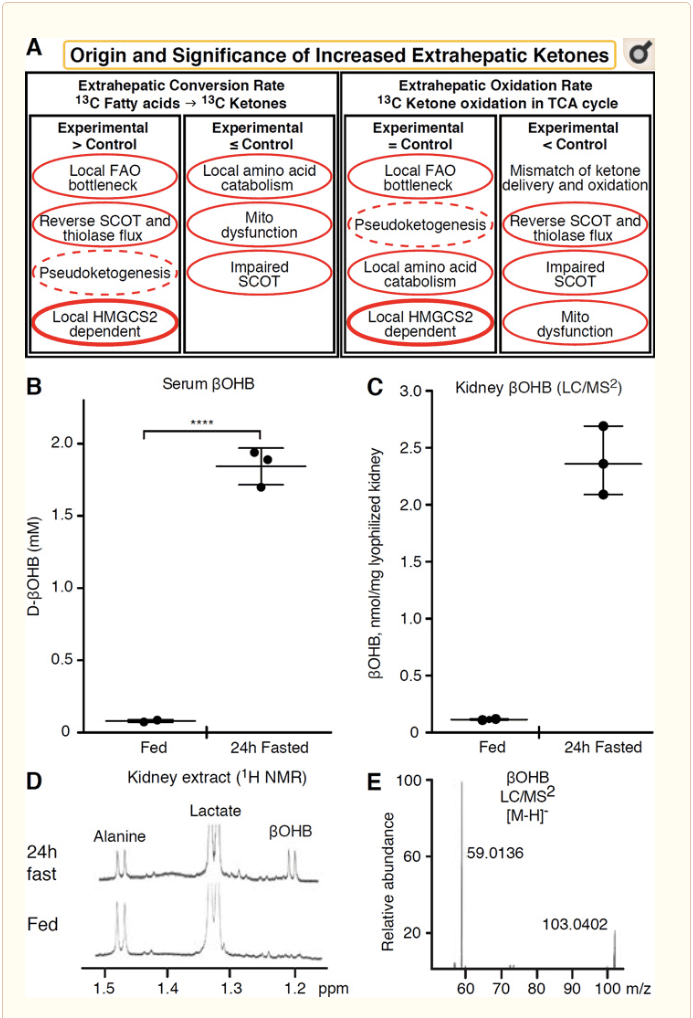

� Бубрези су недавно добили пажњу као потенцијално кетогени орган. У великој већини држава, бубрег је нето потрошач кетонских тела добијених из јетре, излучујући или реапсорбујући кетонска тела из крвотока, а бубрег генерално није генератор или концентратор нето кетонских тела (Робинсон и Виллиамсон, 1980). Аутори класичне студије су закључили да минимална бубрежна кетогенеза квантификована у вештачком експерименталном систему није физиолошки релевантна (Веидеманн и Кребс, 1969). Недавно је дошло до закључка о бубрежној кетогенези код дијабетичких и аутофагијских модела мишева, али је вероватније да вишеорганске промене у метаболичкој хомеостази мењају интегративни метаболизам кетона путем уноса на више органа (Такаги ет ал., 2016а; Такаги ет ал., 2016б; Зханг ет ал., 2011). Једна недавна публикација сугерише бубрежну кетогенезу као заштитни механизам против исхемијске-реперфузијске повреде у бубрегу (Тран ет ал., 2016). Апсолутне стабилне концентрације ?ОХБ из екстраката бубрежног ткива мишева су пријављене на ~4 мМ. Да бисмо тестирали да ли је ово одрживо, квантификовали смо концентрације ?ОХБ у бубрежним екстрактима храњених и 12-часовних гладних мишева. Концентрације ?ОХБ у серуму су порасле са ~24 мМ на 100 мМ уз гладовање од 2 сата (слика 24Б), док су концентрације ?ОХБ у равнотежном стању у бубрегу приближно 2 мМ у стању нахрањености, а само 100 мМ у стању гладовања 1 сата (Сл. 24Ц�Е), запажања која су у складу са концентрацијама квантификованим пре више од 2 година (Хемс и Броснан, 45). Остаје могуће да у кетотичним стањима, кетонска тела добијена из јетре могу бити ренопротективна, али докази за бубрежну кетогенезу захтевају даљу поткрепу. Уверљиви докази који подржавају праву екстрахепатичну кетогенезу представљени су у РПЕ (Адијанто ет ал., 1970). Предложено је да ова интригантна метаболичка трансформација потенцијално омогући кетонима добијеним из РПЕ да тече до фоторецепторских или Мелерових ћелија глије, што би могло помоћи у регенерацији спољашњег сегмента фоторецептора.
?ОХБ као посредник у сигнализацији
Иако су енергетски богата, кетонска тела имају провокативну „неканонску” сигналну улогу у ћелијској хомеостази (слика 3) (Невман и Вердин, 2014; Ројас-Моралес ет ал., 2016). На пример, ?ОХБ инхибира ХДАЦ класе И, што повећава ацетилацију хистона и на тај начин индукује експресију гена који смањују оксидативни стрес (Схимазу ет ал., 2013). ?ОХБ је сам по себи ковалентни модификатор хистона на резидуе лизина у јетри дијабетичких мишева наташте или изазваних стрептозотоцином (Ксие ет ал., 2016) (такође видети испод, Интеграција метаболизма кетонских тела, посттранслациона модификација и физиологија ћелије, и Кетонска тела, оксидативни стрес и неуропротекција).
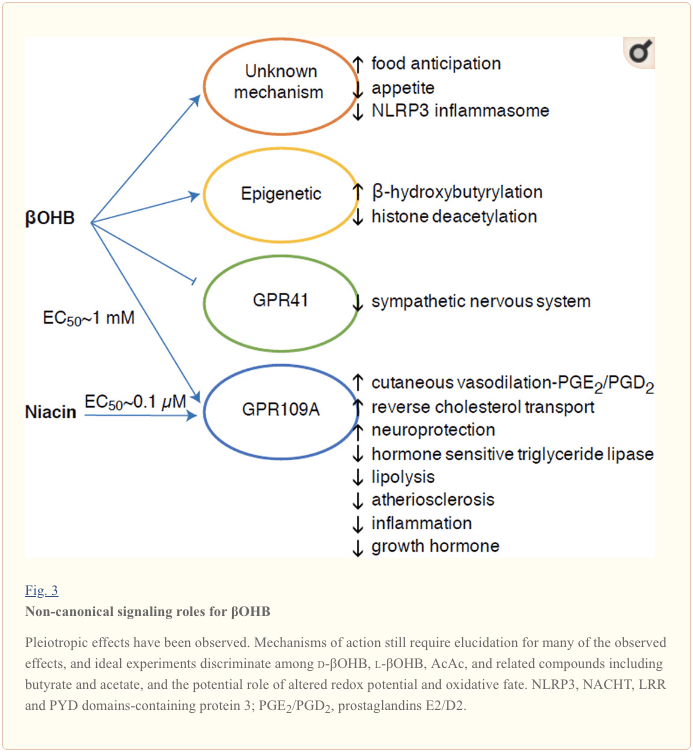
?ОХБ је такође ефектор преко рецептора везаних за Г-протеин. Кроз нејасне молекуларне механизме, он потискује активност симпатичког нервног система и смањује укупну потрошњу енергије и срчану фреквенцију инхибирањем кратколанчане сигнализације масних киселина преко Г протеина спрегнутог рецептора 41 (ГПР41) (Кимура ет ал., 2011). Један од најпроучаванијих сигналних ефеката ?ОХБ се одвија преко ГПР109А (такође познатог као ХЦАР2), члана подфамилије ГПЦР хидрокарбоксилне киселине изражене у масном ткиву (белом и браон) (Тунару ет ал., 2003), и у имуне ћелије (Ахмед ет ал., 2009). ?ОХБ је једини познати ендогени лиганд ГПР109А рецептора (ЕЦ50 ~770 мМ) активиран д-?ОХБ, л-?ОХБ и бутиратом, али не и АцАц (Таггарт ет ал., 2005). Високи праг концентрације за активацију ГПР109А постиже се придржавањем кетогене дијете, гладовањем или током кетоацидозе, што доводи до инхибиције липолизе масног ткива. Анти-липолитички ефекат ГПР109А се одвија кроз инхибицију аденилил циклазе и смањење цАМП, инхибирајући хормон осетљиву триглицерид липазу (Ахмед ет ал., 2009; Тунару ет ал., 2003). Ово ствара негативну повратну петљу у којој кетоза поставља модулациону кочницу кетогенезе смањујући ослобађање неестерификованих масних киселина из адипоцита (Ахмед ет ал., 2009; Таггарт ет ал., 2005), ефекат који се може уравнотежити симпатички нагон који стимулише липолизу. Ниацин (витамин Б3, никотинска киселина) је моћан (ЕЦ50 ~ 0.1 µМ) лиганд за ГРП109А, који се деценијама ефикасно користи за дислипидемије (Бенио ет ал., 2005; Бенио ет ал., 2006; Фаббрини ет ал., 2010; Лукасова и сар., 2011; Тунару и сар., 2003). Док ниацин појачава обрнути транспорт холестерола у макрофагима и смањује атеросклеротске лезије (Лукасова ет ал., 2011), ефекти ?ОХБ на атеросклеротске лезије остају непознати. Иако ГПР109А рецептор има заштитну улогу, а постоје интригантне везе између употребе кетогене дијете код можданог удара и неуродегенеративних болести (Фу ет ал., 2015; Рахман ет ал., 2014), заштитна улога ?ОХБ преко ГПР109А није доказана ин виво .
Коначно, ?ОХБ може утицати на апетит и ситост. Мета-анализа студија које су мериле ефекте кетогене и веома нискоенергетске дијете закључила је да учесници који конзумирају ове дијете показују већу ситост у поређењу са контролном исхраном (Гибсон ет ал., 2015). Међутим, прихватљиво објашњење за овај ефекат су додатни метаболички или хормонски елементи који могу модулирати апетит. На пример, мишеви држани на кетогеној исхрани глодара показали су повећану потрошњу енергије у поређењу са мишевима који су храњени контролном храном, упркос сличном уносу калорија, а циркулишући лептин или гени пептида који регулишу понашање при храњењу нису промењени (Кеннеди ет ал., 2007). Међу предложеним механизмима који сугеришу супресију апетита помоћу ?ОХБ укључују и сигнализацију и оксидацију (Лаегер ет ал., 2010). Хепатоцитна делеција гена циркадијалног ритма (Пер2) и студије имунопреципитације хроматина откриле су да ПЕР2 директно активира ген Цпт1а и индиректно регулише Хмгцс2, што доводи до поремећене кетозе код Пер2 нокаут мишева (Цхаван ет ал.,). Ови мишеви су испољили нарушено очекивање хране, које је делимично обновљено системском администрацијом ?ОХБ. Будуће студије ће бити потребне да би се потврдило да је централни нервни систем директна мета ?ОХБ, и да ли је за уочене ефекте потребна оксидација кетона или је укључен други сигнални механизам. Други истраживачи су се позвали на могућност локалне кетогенезе изведене из астроцита унутар вентромедијалног хипоталамуса као регулатора уноса хране, али ова прелиминарна запажања ће такође имати користи од генетских и процена заснованих на флуксу (Ле Фолл ет ал., 2016). Однос између кетозе и недостатка хранљивих материја остаје занимљив јер су глад и ситост важни елементи у неуспелим покушајима губитка тежине.
Интеграција метаболизма кетонског тела, посттранслациона модификација и физиологија ћелије
Кетонска тела доприносе одвојеним групама ацетил-ЦоА, кључног интермедијера који показује истакнуту улогу у ћелијском метаболизму (Пиетроцола ет ал., 2015). Једна улога ацетил-ЦоА је да служи као супстрат за ацетилацију, ензимски катализовану ковалентну модификацију хистона (Цхоудхари ет ал., 2014; Дутта ет ал., 2016; Фан ет ал., 2015; Мензиес ет ал., 2016. ). Велики број динамички ацетилираних митохондријалних протеина, од којих се многи могу јавити кроз неензимске механизме, такође је произашао из студија рачунарске протеомике (Диттенхафер-Реед ет ал., 2015; Хеберт ет ал., 2013; Рардин ет ал., 2013. Схимазу ет ал., 2010). Лизин деацетилазе користе кофактор цинка (нпр. нуклеоцитосолни ХДАЦ) или НАД+ као ко-супстрат (сиртуини, СИРТ) (Цхоудхари ет ал., 2014; Мензиес ет ал., 2016). Ацетилпротеом служи и као сензор и као ефектор укупног ћелијског ацетил-ЦоА пула, пошто физиолошке и генетске манипулације свака резултирају неензимским глобалним варијацијама ацетилације (Веинерт ет ал., 2014). Како интрацелуларни метаболити служе као модулатори ацетилације резидуа лизина, важно је размотрити улогу кетонских тела, чија је заступљеност веома динамична.
? ОХБ је епигенетски модификатор кроз најмање два механизма. Повећани? ОХБ нивои индуковани гладовањем, рестрикцијама калорија, директном администрацијом или продуженим вежбањем изазивају инхибицију ХДАЦ или активацију хистон ацетилтрансферазе (Мароси и сар., 2016; Слеиман и сар., 2016) или на оксидативни стрес (Схимазу и сар., 2013) . ? ОХБ инхибиција ХДАЦ3 могла би да регулише метаболичку физиологију новорођенчади (Рандо и сар., 2016). Независно, сам ОХБ директно модификује остатке хистон лизина (Ксие ет ал., 2016). Продужено гладовање или дијабетесна кетоацидоза изазвана стептозотоцином повећала је хистон-хидроксибутирилацију. Иако је број места лизин-хидроксибутирилације и ацетилације био упоредив, примећена је стехиометријски већа хистон-а-хидроксибутирилација од ацетилације. На различите гене утицали су хистон-лизин-хидроксибутирилација насупрот ацетилацији или метилацији, што сугерише различите ћелијске функције. Није познато да ли је? -Хидроксибутирилација спонтана или ензимска, али проширује опсег механизама кроз кетонска тела која динамички утичу на транскрипцију.
Суштински догађаји репрограмирања ћелија током калоријске рестрикције и лишавања хранљивих састојака могу бити посредовани у СИРТ3- и СИРТ5-зависној деацетилацији и десуцинилацији митохондрија, регулишући кетогене и кетолитичке протеине на пост-транслацијском нивоу у јетри и екстрахепатичним ткивима (Диттенхафер-Реед ет ал. 2015; Хеберт и сар., 2013; Рардин и сар., 2013; Схимазу и сар., 2010). Иако стехиометријско поређење заузетих места не мора нужно да се директно повезује са променама у метаболичком флуксу, ацетилација митохондрија је динамична и може бити вођена концентрацијом ацетил-ЦоА или пХ митохондрија, а не ензиматским ацетилтрансферазама (Вагнер и Паине, 2013). Да СИРТ3 и СИРТ5 модулирају активности ензима који метаболизирају кетонско тело, провоцира се питање узајамне улоге кетона у обликовању ацетилпротеома, сукцинилпротеома и других динамичних ћелијских циљева. Заправо, како варијације кетогенезе одражавају концентрације НАД +, производња и број кетона могу да регулишу активност сиртуина, утичући тако на укупне базене ацетил-ЦоА / сукцинил-ЦоА, ацилпротеом, а тиме и на митохондријску и ћелијску физиологију. ? -хидроксибутирилација остатака ензима лизина могла би да дода још један слој ћелијском репрограмирању. У екстрахепатичним ткивима, оксидација кетонског тела може стимулисати аналогне промене у ћелијској хомеостази. Иако је раздвајање базена ацетил-ЦоА високо регулисано и координира широк спектар ћелијских промена, способност кетонских тела да директно обликују и митохондријске и цитоплазматске концентрације ацетил-ЦоА захтева разјашњење (Цхен ет ал., 2012; Цорбет ет ал., 2016; Поуговкина и сар., 2014; Сцхвер и сар., 2009; Веллен и Тхомпсон, 2012). Будући да су концентрације ацетил-ЦоА строго регулисане, а ацетил-ЦоА је непропусна за мембрану, пресудно је размотрити покретачке механизме који координирају хомеостазу ацетил-ЦоА, укључујући брзине производње и терминалне оксидације у ТЦА циклусу, претварање у кетонска тела, митохондријске излив преко карнитин ацетилтрансферазе (ЦрАТ) или извоз ацетил-ЦоА у цитосол након конверзије у цитрат и ослобађање АТП цитрат лиазом (АЦЛИ). Кључне улоге ових потоњих механизама у ћелијском ацетилпротеому и хомеостази захтевају одговарајуће разумевање улога кетогенезе и оксидације кетона (Дас ет ал., 2015; МцДоннелл ет ал., 2016; Моуссаиефф ет ал., 2015; Овермиер ет ал., 2015; Сеилер и сар., 2014; Сеилер и сар., 2015; Веллен и сар., 2009; Веллен и Тхомпсон, 2012). За одређивање циљева и исхода биће потребне конвергентне технологије у метаболомици и ацилпротеомици у постављању генетски манипулисаних модела.
Анти- и про-инфламаторни одговори на кетонска тела
Кетоза и кетонска тела модулирају упале и функцију имуних ћелија, али су предложени различити, па чак и нескладни механизми. Дуготрајно ускраћивање хранљивих састојака смањује упалу (Иоум и сар., 2015), али хронична кетоза дијабетеса типа 1 је проупално стање (Јаин и сар., 2002; Каникарла-Марие и Јаин, 2015; Курепа и сар., 2012 ). Сигналне улоге засноване на механизму за ОХБ у упали настају зато што многе ћелије имуног система, укључујући макрофаге или моноците, обилно изражавају ГПР109А. Иако? ОХБ врши претежно антиинфламаторни одговор (Фу и сар., 2014; Гамбхир и сар., 2012; Рахман и сар., 2014; Иоум и сар., 2015), високе концентрације кетонских тела, посебно АцАц, могу покрећу про-инфламаторни одговор (Јаин ет ал., 2002; Каникарла-Марие анд Јаин, 2015; Курепа ет ал., 2012).
Размотрене су антиинфламаторне улоге лиганда ГПР109А у атеросклерози, гојазности, инфламаторној болести црева, неуролошким болестима и канцеру (Графф ет ал., 2016). Експресија ГПР109А је повећана у РПЕ ћелијама дијабетичких модела, пацијената са дијабетесом код људи (Гамбхир ет ал., 2012) и у микроглија током неуродегенерације (Фу ет ал., 2014). Анти-инфламаторни ефекти ?ОХБ су појачани прекомерном експресијом ГПР109А у РПЕ ћелијама, а поништени су фармаколошком инхибицијом или генетским нокаутом ГПР109А (Гамбхир ет ал., 2012). ?ОХБ и егзогена никотинска киселина (Таггарт ет ал., 2005), обе дају антиинфламаторне ефекте у ТНФ? или запаљење изазвано ЛПС смањењем нивоа проинфламаторних протеина (иНОС, ЦОКС-2) или излучених цитокина (ТНФ?, ИЛ-1?, ИЛ-6, ЦЦЛ2/МЦП-1), делимично кроз инхибицију НФ -?Б транслокација (Фу ет ал., 2014; Гамбхир ет ал., 2012). ?ОХБ смањује ЕР стрес и НЛРП3 инфламазом, активирајући одговор на антиоксидативни стрес (Бае ет ал., 2016; Иоум ет ал., 2015). Међутим, код неуродегенеративне упале, ГПР109А зависна ?ОХБ-посредована заштита не укључује инфламаторне медијаторе као што је сигнализација МАПК пута (нпр. ЕРК, ЈНК, п38) (Фу ет ал., 2014), али може захтевати ПГД1 зависан од ЦОКС-2 производње (Рахман ет ал., 2014). Интригантно је да је макрофаг ГПР109А потребан да би имао неуропротективни ефекат у моделу исхемијског можданог удара (Рахман ет ал., 2014), али способност ?ОХБ да инхибира НЛРП3 инфламазом у макрофагима добијеним из коштане сржи је независна (ГПР109А и др. ., 2015). Иако већина студија повезује ?ОХБ са антиинфламаторним ефектима, ?ОХБ може бити проинфламаторни и повећати маркере липидне пероксидације у хепатоцитима телета (Схи ет ал., 2014). Анти-версус про-инфламаторни ефекти ?ОХБ могу стога зависити од типа ћелије, концентрације ?ОХБ, трајања излагања и присуства или одсуства комодулатора.
За разлику од? ОХБ, АцАц може активирати про-инфламаторну сигнализацију. Повишени АцАц, посебно са високом концентрацијом глукозе, појачава повреду ендотелних ћелија кроз механизам зависан од НАДПХ оксидазе / оксидативног стреса (Каникарла-Марие и Јаин, 2015). Високе концентрације АцАц у пупчаној врпци мајки дијабетичарки биле су у корелацији са већом стопом оксидације протеина и концентрацијом МЦП-1 (Курепа и сар., 2012). Висок ниво АцАц код дијабетичара био је у корелацији са ТНФ? експресија (Јаин ет ал., 2002) и АцАц, али не и? ОХБ, индуковани ТНФа, експресија МЦП-1, акумулација РОС и смањени ниво цАМП у ћелијама хуманих моноцита У937 (Јаин ет ал., 2002; Курепа ет ал. ., 2012).
Сигнални феномени који зависе од кетонског тела често се покрећу само код високих концентрација кетонског тела (> 5 мМ), ау случају многих студија које кетоне повезују са про- или антиинфламаторним ефектима, путем нејасних механизама. Поред тога, због контрадикторних ефеката? ОХБ наспрам АцАц на упалу и способности односа АцАц /? ОХБ да утиче на редокс потенцијал митохондрија, најбољи експерименти који процењују улогу кетонских тела на ћелијским фенотиповима упоређују ефекте АцАц и? ОХБ у различитим односима и у различитим кумулативним концентрацијама [нпр. (Саито и сар., 2016)]. Коначно, АцАц се може комерцијално купити само као литијумова со или као етил естар који захтева базну хидролизу пре употребе. Литијумски катион независно индукује каскаде преноса сигнала (Мањи и сар., 1995), а АцАц анион је лабилан. На крају, студије које користе рацемични д / л-? ОХБ могу бити збуњене, јер само д-? ОХБ стереоизомер може да се оксидује у АцАц, али д-? ОХБ и л-? ОХБ могу сваки да сигнализирају путем ГПР109А, инхибирају НЛРП3 инфламацију, и служе као липогени супстрати.
Кетонска тела, оксидативни стрес и неуропротекција
Оксидативни стрес се обично дефинише као стање у коме су РОС присутни у вишку, услед прекомерне производње и/или ослабљене елиминације. Улоге кетонских тела које ублажавају антиоксидативни и оксидативни стрес су широко описане и ин витро и ин виво, посебно у контексту неуропротекције. Како већина неурона не ствара ефикасно високоенергетске фосфате из масних киселина, али оксидирају кетонска тела када су угљени хидрати у недостатку, неуропротективни ефекти кетонских тела су посебно важни (Цахилл ГФ Јр, 2006; Едмонд ет ал., 1987; Ианг ет ал., 1987). У моделима оксидативног стреса, индукција БДХ1 и СЦОТ супресија сугеришу да се метаболизам кетонских тела може репрограмирати да би се одржао различита ћелијска сигнализација, редокс потенцијал или метаболичке потребе (Нагао ет ал., 2016; Тиеу ет ал., 2003).
Кетонска тела смањују степен ћелијског оштећења, повреде, смрти и ниже апоптозе у неуронима и кардиомиоцитима (Хацес ет ал., 2008; Маалоуф ет ал., 2007; Нагао ет ал., 2016; Тиеу ет ал., 2003). Позвани механизми су разноврсни и нису увек линеарно повезани са концентрацијом. Ниске милимоларне концентрације (д или л)-?ОХБ уклањају РОС (хидроксил ањон), док АцАц уклања бројне врсте РОС, али само у концентрацијама које прелазе физиолошки опсег (ИЦ50 20 мМ) (Хацес ет ал., 67) . Насупрот томе, благотворан утицај на редокс потенцијал ланца транспорта електрона је механизам који је обично повезан са д-?ОХБ. Док су сва три кетонска тела (д/л-?ОХБ и АцАц) смањила смрт неуронских ћелија и акумулацију РОС изазвану хемијском инхибицијом гликолизе, само д-?ОХБ и АцАц су спречили пад неуронског АТП-а. Супротно томе, у хипогликемијском ин виво моделу, (д или л)-?ОХБ, али не и АцАц, спречили су пероксидацију липида хипокампуса (Хацес ет ал., 2008; Маалоуф ет ал., 2008; Мароси ет ал., 2007; Мурпхи, 2016 Тиеу ет ал., 2009). Ин виво студије на мишевима храњеним кетогеном исхраном (2003% кцал масти и 87% протеина) су показале неуроанатомске варијације антиоксидативног капацитета (Зиеглер ет ал., 13), где су најдубље промене примећене у хипокампусу, са повећањем глутатион пероксидазе и укупног антиоксидативни капацитети.
Кетогена дијета, кетонски естри (такође видети Терапијска употреба кетогене дијете и егзогена кетонска тела) или примена ?ОХБ врше неуропротекцију у моделима исхемијског можданог удара (Рахман ет ал., 2014); Паркинсонова болест (Тиеу ет ал., 2003); напад токсичности кисеоника централног нервног система (Д'Агостино ет ал., 2013); епилептички грчеви (Иум ет ал., 2015); синдром митохондријалне енцефаломиопатије, лактацидозе и епизода сличних можданом удару (МЕЛАС) (Фреи ет ал., 2016) и Алцхајмерове болести (Цуннане и Цравфорд, 2003; Иин ет ал., 2016). Насупрот томе, недавни извештај је показао хистопатолошке доказе неуродегенеративне прогресије кетогеном исхраном у моделу трансгеног миша абнормалне поправке митохондријске ДНК, упркос повећању митохондријалне биогенезе и антиоксидативних потписа (Лауритзен ет ал., 2016). Други опречни извештаји сугеришу да излагање високим концентрацијама кетонских тела изазива оксидативни стрес. Високе дозе ?ОХБ или АцАц изазвале су секрецију азотног оксида, пероксидацију липида, смањену експресију СОД, глутатион пероксидазе и каталазе у хепатоцитима телета, док је у хепатоцитима пацова индукција МАПК пута приписана АцАц, али не и ?ОХБ (Абделмегеед2004, сар. ; Схи ет ал., 2014; Схи ет ал., 2016).
Узети заједно, већина извештаја повезује ОХБ са ублажавањем оксидативног стреса, јер његова примена инхибира производњу РОС / супероксида, спречава пероксидацију липида и оксидацију протеина, повећава ниво антиоксидативних протеина и побољшава митохондријско дисање и производњу АТП (Абделмегеед ет ал., 2004; Хацес и сар., 2008; Јаин и сар., 1998; Јаин и сар., 2002; Каникарла-Марие и Јаин, 2015; Маалоуф и сар., 2007; Маалоуф и Рхо, 2008; Мароси и сар., 2016; Тиеу и сар., 2003; Иин и сар., 2016; Зиеглер и сар., 2003). Иако је АцАц у директнијој корелацији са? ОХБ са индукцијом оксидативног стреса, ови ефекти се не рашчлањују увек из потенцијалних про-инфламаторних одговора (Јаин ет ал., 2002; Каникарла-Марие и Јаин, 2015; Каникарла-Марие и Јаин, 2016). Штавише, од кључне је важности узети у обзир да очигледна антиоксидативна корист коју дају плеиотропне кетогене дијете не могу сама пренијети кетонска тијела, а неуропротекција коју дају кетонска тијела можда се у потпуности не може приписати оксидативном стресу. На пример, током лишавања глукозе, у моделу лишавања глукозе у кортикалним неуронима,? ОХБ је стимулисао аутофагични ток и спречио акумулацију аутофагосома, што је повезано са смањеном неуронском смрћу (Цамберос-Луна ет ал., 2016). д-? ОХБ такође индукује канонске антиоксидативне протеине ФОКСО3а, СОД, МнСОД и каталазу, проспективно путем инхибиције ХДАЦ (Нагао ет ал., 2016; Схимазу ет ал., 2013).
Неалкохолна болест масне јетре (НАФЛД) и метаболизам кетонског тела
НАФЛД повезан са гојазношћу и неалкохолни стеатохепатитис (НАСХ) су најчешћи узроци болести јетре у западним земљама (Ринелла и Саниал, 2016), а НАСХ-индукована инсуфицијенција јетре један је од најчешћих разлога за трансплантацију јетре. Док вишак складиштења триацилглицерола у хепатоцитима >5% тежине јетре (НАФЛ) сам по себи не узрокује дегенеративну функцију јетре, прогресија до НАФЛД код људи корелира са системском инсулинском резистенцијом и повећаним ризиком од дијабетеса типа 2, и може допринети патогенези кардиоваскуларне болести и хроничне болести бубрега (Фаббрини ет ал., 2009; Таргхер ет ал., 2010; Таргхер и Бирне, 2013). Патогени механизми НАФЛД и НАСХ нису у потпуности схваћени, али укључују абнормалности метаболизма хепатоцита, аутофагију хепатоцита и стрес ендоплазматског ретикулума, функцију имуних ћелија јетре, упалу масног ткива и системске инфламаторне медијаторе (Фаббрини ет ал., 2009; 2013; Таргхер ет ал., 2010, Ианг ет ал., 2010). Поремећаји метаболизма угљених хидрата, липида и аминокиселина се јављају и доприносе гојазности, дијабетесу и НАФЛД код људи и моделских организама [прегледано у (Фаресе ет ал., 2012; Лин и Аццили, 2011; Невгард, 2012; Самуел и Шулман, 2012; Сунце и Лазар, 2013)]. Док се абнормалности хепатоцита у цитоплазматском метаболизму липида обично примећују код НАФЛД (Фаббрини ет ал., 2010б), улога митохондријалног метаболизма, који управља оксидативним одлагањем масти, мање је јасна у патогенези НАФЛД. Абнормалности митохондријалног метаболизма се јављају и доприносе патогенези НАФЛД/НАСХ (Хиотилаинен ет ал., 2016; Сервиддио ет ал., 2011; Сервиддио ет ал., 2008; Веи ет ал., 2008). Постоји генерално (Фелиг ет ал., 1974; Иоззо ет ал., 2010; Колиаки ет ал., 2015; Сатапати ет ал., 2015; Сатапати ет ал., 2012; Сунни ет ал., 2011), али није уједначено ( Колиаки и Роден, 2013; Перри ет ал., 2016; Рецтор ет ал., 2010) консензус да је, пре развоја бона фиде НАСХ, хепатична митохондријална оксидација, а посебно оксидација масти, повећана у гојазности, системској резистенцији на инсулин и НАФЛД. Вероватно је да како НАФЛД напредује, хетерогеност оксидативног капацитета, чак и међу појединачним митохондријама, се појављује, и на крају оксидативна функција постаје оштећена (Колиаки ет ал., 2015; Рецтор ет ал., 2010; Сатапати ет ал., 2008; Сатапати ет ал. ., 2012).
Кетогенеза се често користи као замена за оксидацију масти у јетри. Оштећења кетогенезе се појављују како НАФЛД напредује на животињским моделима, а вероватно и код људи. Преко непотпуно дефинисаних механизама, хиперинсулинемија потискује кетогенезу, што вероватно доприноси хипокетонемији у поређењу са мршавим контролама (Бергман ет ал., 2007; Бицкертон ет ал., 2008; Сатапати ет ал., 2012; Соетерс ет ал., Сунни ет ал., 2009; , 2011; Вице ет ал., 2005). Без обзира на то, способност циркулишућих концентрација кетонских тела да предвиде НАФЛД је контроверзна (М�ннист� ет ал., 2015; Саниал ет ал., 2001). Робустне квантитативне спектроскопске методе магнетне резонанце на животињским моделима откриле су повећану стопу обртања кетона са умереном инсулинском резистенцијом, али смањене стопе су евидентне код теже инсулинске резистенције (Сатапати ет ал., 2012; Сунни ет ал., 2010). Код гојазних људи са масном јетром, кетогена стопа је нормална (Бицкертон ет ал., 2008; Сунни ет ал., 2011), и стога су стопе кетогенезе смањене у односу на повећано оптерећење масним киселинама унутар хепатоцита. Сходно томе, ацетил-ЦоА изведен из α-оксидације може бити усмерен на терминалну оксидацију у ТЦА циклусу, повећавајући терминалну оксидацију, глуконеогенезу изазвану фосфоенолпируватом преко анаплерозе/катаплерозе и оксидативни стрес. Ацетил-ЦоА такође се вероватно извози из митохондрија као цитрат, прекурсорски супстрат за липогенезу (слика 4) (Сатапати ет ал., 2015; Сатапати ет ал., 2012; Солинас ет ал., 2015). Док кетогенеза постаје мање осетљива на инсулин или гладовање са продуженом гојазношћу (Сатапати ет ал., 2012), основни механизми и последице овога остају непотпуно схваћени. Недавни докази показују да мТОРЦ1 потискује кетогенезу на начин који може бити низводно од инсулинске сигнализације (Куцејова ет ал., 2016), што је у складу са запажањима да мТОРЦ1 инхибира индукцију Хмгцс2 посредовану ППАР? (Сенгупта ет ал., 2010). такође видети Уредбу ХМГЦС2 и СЦОТ/ОКСЦТ1).

Прелиминарна запажања наше групе указују на штетне последице кетогене инсуфицијенције на јетру (Цоттер ет ал., 2014). Да бисмо тестирали хипотезу да поремећена кетогенеза, чак и у стањима пуне угљених хидрата и самим тим 'некетогених', доприноси абнормалном метаболизму глукозе и провоцира стеатохепатитис, генерисали смо мишји модел изражене кетогене инсуфицијенције давањем антисенсног олигонукле (АСО) Хмгцс2. Губитак ХМГЦС2 код одраслих мишева храњених са ниским садржајем масти изазвао је благу хипергликемију и значајно повећану производњу стотина јетрених метаболита, чији скуп снажно указује на активацију липогенезе. Исхрана мишева са високим садржајем масти са недовољном кетогенезом резултирала је опсежним оштећењем и упалом хепатоцита. Ови налази подржавају централну хипотезу да (и) кетогенеза није пасивни пут преливања, већ динамички чвор у јетри и интегрисаној физиолошкој хомеостази, и (ии) опрезно кетогено повећање за ублажавање НАФЛД/НАСХ и поремећеног метаболизма глукозе у јетри је вредно истраживања. .
Како оштећена кетогенеза може допринети оштећењу јетре и измењеној хомеостази глукозе? Прво разматрање је да ли је кривац недостатак кетогеног флукса или самих кетона. Недавни извештај сугерише да кетонска тела могу да ублаже повреду јетре изазвану оксидативним стресом као одговор на н-3 полинезасићене масне киселине (Павлак ет ал., 2015). Подсетимо се да због недостатка експресије СЦОТ у хепатоцитима, кетонска тела нису оксидирана, али могу допринети липогенези и служе различитим сигналним улогама неовисно од њихове оксидације (такође видети Неоксидативне метаболичке судбине кетонских тела и? ОХБ као сигнални посредник). Такође је могуће да кетонска тела изведена из хепатоцита могу послужити као сигнал и / или метаболит за суседне типове ћелија унутар јетреног ацинуса, укључујући звездане ћелије и макрофаге Купффер ћелија. Иако ограничена расположива литература сугерише да макрофаги нису у стању да оксидирају кетонска тела, то је мерено само класичним методологијама и то само у перитонеалним макрофагима (Невсхолме и сар., 1986; Невсхолме и сар., 1987), што указује на то да процена је прикладна с обзиром на обилну експресију СЦОТ у макрофазима изведеним из коштане сржи (Иоум ет ал., 2015).
Кетогени флукс хепатоцита такође може бити цитопротективан. Док спасоносни механизми можда не зависе од кетогенезе саме по себи, кетогене дијете са мало угљених хидрата су повезане са побољшањем НАФЛД-а (Бровнинг ет ал., 2011; Фостер ет ал., 2010; Кани ет ал., 2014; Сцхугар и Цравфорд, 2012) . Наша запажања показују да кетогенеза хепатоцита може дати повратну информацију и регулисати ток ТЦА циклуса, анаплеротични ток, глуконеогенезу изведену из фосфоенолпирувата (Цоттер ет ал., 2014), па чак и промет гликогена. Кетогено оштећење усмерава ацетил-ЦоА на повећање протока ТЦА, што је у јетри повезано са повећаном повредом посредованом РОС (Сатапати ет ал., 2015; Сатапати ет ал., 2012); присиљава преусмеравање угљеника у де ново синтетизоване липидне врсте које би се могле показати цитотоксичним; и спречава реоксидацију НАДХ у НАД+ (Цоттер ет ал., 2014) (слика 4). Узети заједно, потребни су будући експерименти да би се позабавили механизмима кроз које релативна кетогена инсуфицијенција може постати неприлагођена, допринети хипергликемији, изазвати стеатохепатитис и да ли ови механизми делују у хуманом НАФЛД/НАСХ. Као што епидемиолошки докази сугеришу поремећену кетогенезу током прогресије стеатохепатитиса (Ембаде ет ал., 2016; Мариноу ет ал., 2011; М�ннист� ет ал., 2015; Прамфалк ет ал., 2015; Сафаеи ет ал.), 2016 терапије које повећавају кетогенезу јетре могле би се показати корисним (Дегироламо ет ал., 2016; Хонда ет ал., 2016).
Кетонска тела и срчана инсуфицијенција (ХФ)
Са метаболичком брзином која прелази 400 кцал/кг/дан и прометом од 6 кг АТП/дан, срце је орган са највећим утрошком енергије и оксидативним потребама (Асхрафиан ет ал., 35; Ванг ет ал., 2007б). Огромна већина промета енергије миокарда налази се у митохондријама, а 2010% овог снабдевања потиче од ФАО. Срце је свеједо и флексибилно у нормалним условима, али срце које се патолошки ремоделује (нпр. услед хипертензије или инфаркта миокарда) и срце дијабетичара постају метаболички нефлексибилни (Балассе и Фери, 70; БИНГ, 1989; Фукао ет ал., 1954). ; Лопасцхук ет ал., 2004; Таегтмеиер ет ал., 2010; Таегтмеиер ет ал., 1980; Иоунг ет ал., 2002). Заиста, генетски програмиране абнормалности метаболизма срчаног горива у моделима мишева изазивају кардиомиопатију (Царлеи ет ал., 2002; Неубауер, 2014). У физиолошким условима нормално срце оксидира кетонска тела пропорционално њиховој испоруци, на рачун оксидације масних киселина и глукозе, а миокард је највећи потрошач кетонског тела по јединици масе (БИНГ, 2007; Цравфорд ет ал., 1954; ГАРЛАНД ет ал. ., 2009; Хасселбаинк ет ал., 1962; Јеффреи ет ал., 2003; Пеллетиер ет ал., 1995; Тардиф ет ал., 2007; Иан ет ал., 2001). У поређењу са оксидацијом масних киселина, кетонска тела су енергетски ефикаснија, дајући више енергије доступне за синтезу АТП-а по уложеном молекулу кисеоника (П/О однос) (Касхиваиа ет ал., 2009; Сато ет ал., 2010; Веецх, 1995) . Оксидација кетонских тела такође даје потенцијално већу енергију од ФАО, одржавајући убихинон оксидованим, што повећава редокс распон у ланцу транспорта електрона и чини више енергије доступном за синтетизацију АТП-а (Сато ет ал., 2004; Веецх, 1995). Оксидација кетонских тела такође може смањити производњу РОС, а тиме и оксидативни стрес (Веецх, 2004).
Прелиминарне интервенцијске и опсервационе студије указују на потенцијалну спасоносну улогу кетонских тела у срцу. У експерименталном контексту исхемије / реперфузијске повреде, кетонска тела су дала потенцијалне кардиопротективне ефекте (Ал-Заид и сар., 2007; Ванг и сар., 2008), вероватно због повећања обиља митохондрија у срцу или појачане регулације кључне оксидативне фосфорилације посредници (Снорек и сар., 2012; Зоу и сар., 2002). Недавна испитивања показују да је употреба кетонског тела повећана у затајелим срцима мишева (Ауберт и сар., 2016) и људи (Беди и сар., 2016), подржавајући претходна запажања на људима (БИНГ, 1954; Фукао и сар., 2000; Јанардхан и сар., 2011; Лонго и сар., 2004; Рудолпх и Сцхинз, 1973; Тилдон и Цорнблатх, 1972). Концентрације тела у циркулацији кетона повећане су код пацијената са срчаном инсуфицијенцијом, пропорционално с притисцима пуњења, запажања чији механизам и значај остају непознати (Купари и сар., 1995; Ломми и сар., 1996; Ломми и сар., 1997; Неели и сар. ., 1972), али мишеви са селективним СЦОТ недостатком у кардиомиоцитима показују убрзано патолошко преуређивање коморе и РОС потписе као одговор на хируршки изазвану повреду преоптерећења притиском (Сцхугар ет ал., 2014).
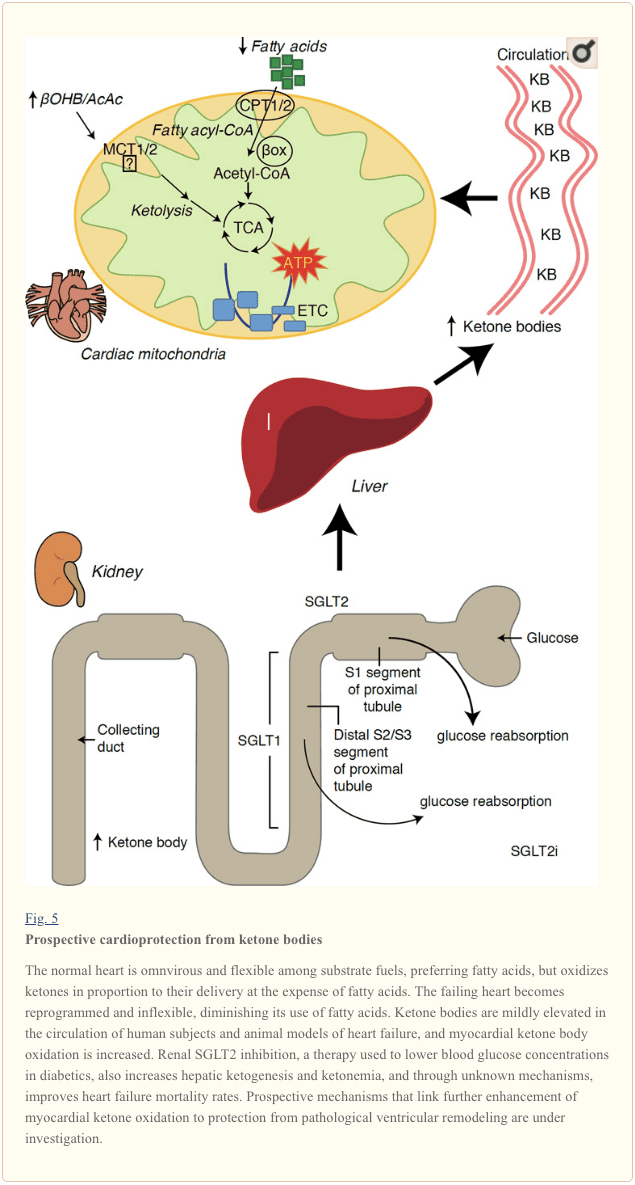
Недавна интригантна запажања у терапији дијабетеса открила су потенцијалну везу између метаболизма кетона миокарда и патолошког преуређивања вентрикула (слика 5). Инхибиција бубрежног проксималног тубуларног ко-транспортера натријум / глукоза 2 (СГЛТ2и) повећава концентрацију кетонског тела у циркулацији код људи (Ферраннини и сар., 2016а; Инагаки и сар., 2015) и мишева (Сузуки и сар., 2014). кетогенеза јетре (Ферраннини и сар., 2014; Ферраннини и сар., 2016а; Катз и Леитер, 2015; Мудалиар и сар., 2015). Запањујуће је да је најмање један од ових средстава смањио ВФ хоспитализацију (нпр. Како је открило ЕМПА-РЕГ ОУТЦОМЕ испитивање) и побољшао кардиоваскуларни морталитет (Фитцхетт и сар., 2016; Сонессон и сар., 2016; Ву и сар., 2016а ; Зинман и сар., 2015). Иако се о покретачким механизмима који стоје иза корисних ХФ исхода повезаног СГЛТ2и и даље активно расправља, о користи за преживљавање је вероватно вишеструко, потенцијално укључујући кетозу, али и спасоносне ефекте на тежину, крвни притисак, ниво глукозе и мокраћне киселине, крутост артерија, симпатички нервни систем, осмотски диуреза / смањена запремина плазме и повећани хематокрит (Раз и Цахн, 2016; Валлон и Тхомсон, 2016). Заједно узев, идеја да терапеутски повећавајућа кетонемија било код ХФ пацијената, било код оних са високим ризиком за развој ХФ, остаје контроверзна, али је под активним испитивањем у предклиничким и клиничким студијама (Ферраннини ет ал., 2016б; Колвицз ет ал., 2016; Лопасцхук анд Верма, 2016; Мудалиар ет ал., 2016; Таегтмеиер, 2016).
Кетонска тела у биологији рака
Везе између кетонских тела и рака брзо се појављују, али студије на животињским моделима и људима дале су различите закључке. Будући да је метаболизам кетона динамичан и да реагује на нутријенте, примамљиво је наставити са биолошким везама са раком због потенцијала за прецизно вођене нутритивне терапије. Ћелије рака се подвргавају метаболичком репрограмирању како би се одржала брза пролиферација и раст ћелија (ДеНицола и Цантлеи, 2015; Павлова и Тхомпсон, 2016). Класични Варбургов ефекат у метаболизму ћелија карцинома произлази из доминантне улоге гликолизе и ферментације млечне киселине у преносу енергије и компензацији мање зависности од оксидативне фосфорилације и ограниченог дисања митохондрија (Де Феитер и сар., 2016; Грабацка и сар., 2016; Канг и сар., 2015; Пофф и сар., 2014; Схукла и сар., 2014). Угљеник глукозе првенствено се усмерава кроз гликолизу, пут пентоза-фосфата и липогенезу, који заједно дају међупродукте неопходне за ширење биомасе тумора (Грабацка ет ал., 2016; Схукла ет ал., 2014; Иосхии ет ал., 2015). Прилагођавање ћелија карцинома недостатку глукозе догађа се кроз способност искоришћавања алтернативних извора горива, укључујући ацетат, глутамин и аспартат (Јаворски ет ал., 2016; Сулливан ет ал., 2015). На пример, ограничени приступ пирувату открива способност ћелија карцинома да карбоксилацијом претворе глутамин у ацетил-ЦоА, одржавајући и енергетске и анаболичке потребе (Ианг ет ал., 2014). Занимљива адаптација ћелија карцинома је коришћење ацетата као горива (Цомерфорд и сар., 2014; Јаворски и сар., 2016; Масхимо и сар., 2014; Вригхт и Симоне, 2016; Иосхии и сар., 2015). Ацетат је такође супстрат за липогенезу, што је критично за пролиферацију ћелија тумора, а добитак овог липогеног проводника повезан је са краћим преживљавањем пацијената и већим оптерећењем тумора (Цомерфорд ет ал., 2014; Масхимо ет ал., 2014; Иосхии ет ал. ., 2015).
Ћелије без рака лако пребацују свој извор енергије са глукозе на кетонска тела током депривације глукозе. Ова пластичност може бити варијабилнија међу типовима ћелија рака, али ин виво имплантирани тумори мозга су оксидисали [2,4-13Ц2]-?ОХБ у сличном степену као и околно мождано ткиво (Де Феитер ет ал., 2016). Модели „обрнутог Варбурговог ефекта“ или „метаболизма тумора са два одељка“ претпостављају да ћелије рака индукују производњу ?ОХБ у суседним фибробластима, обезбеђујући енергетске потребе ћелије тумора (Бонуццелли ет ал., 2010; Мартинез-Оутсцхоорн ет ал., 2012) . У јетри, померање хепатоцита са кетогенезе на оксидацију кетона у ћелијама хепатоцелуларног карцинома (хепатома) је у складу са активацијом БДХ1 и СЦОТ активности уочених у две ћелијске линије хепатома (Зханг ет ал., 1989). Заиста, ћелије хепатома експримирају ОКСЦТ1 и БДХ1 и оксидирају кетоне, али само када је серум гладан (Хуанг ет ал., 2016). Алтернативно, такође је предложена кетогенеза туморских ћелија. Динамичке промене у експресији кетогеног гена су приказане током канцерогене трансформације епитела дебелог црева, типа ћелије који нормално експримира ХМГЦС2, а недавни извештај сугерише да ХМГЦС2 може бити прогностички маркер лоше прогнозе код колоректалних и сквамозних карцинома (Цамареро ет ал. 2006; Цхен ет ал., 2016). Остаје да се утврди да ли ова асоцијација захтева или укључује кетогенезу, или помоћну функцију ХМГЦС2. Насупрот томе, очигледна производња ?ОХБ ћелијама меланома и глиобластома, стимулисана ППАР? агониста фенофибрата, био је повезан са заустављањем раста (Грабачка и сар., 2016). Потребне су даље студије да би се карактерисале улоге експресије ХМГЦС2/СЦОТ, кетогенезе и оксидације кетона у ћелијама рака.
Изван домена метаболизма горива, кетони су недавно укључени у биологију ћелија карцинома путем сигналног механизма. Анализа БРАФ-В600Е + меланома указала је на ОЦТ1-зависну индукцију ХМГЦЛ на онкогени БРАФ-зависни начин (Канг ет ал., 2015). Повећање ХМГЦЛ корелирано је са вишом ћелијском концентрацијом АцАц, што је заузврат појачало интеракцију БРАФВ600Е-МЕК1, појачавајући МЕК-ЕРК сигнализацију у повратној петљи која покреће пролиферацију и раст туморских ћелија. Ова запажања покрећу интригантно питање потенцијалне екстрахепатичне кетогенезе која тада подржава сигнални механизам (такође видети? ОХБ као сигнални посредник и Контроверзе у екстрахепатичној кетогенези). Такође је важно узети у обзир независне ефекте АцАц, д-? ОХБ и XNUMX-ОХБ на метаболизам карцинома, а када се разматра ХМГЦЛ, катаболизам леуцина такође може бити поремећен.
Ефекти кетогене дијете (такође погледајте Терапијска употреба кетогене дијете и егзогених кетонских тела) на животињским моделима рака су различити (Де Феитер ет ал., 2016; Клемент ет ал., 2016; Меиденбауер ет ал., 2015; Пофф ет ал. ., 2014; Сеифриед и сар., 2011; Шукла и сар., 2014). Док се расправља о епидемиолошким асоцијацијама између гојазности, рака и кетогене дијете (Лискиевицз ет ал., 2016; Вригхт и Симоне, 2016), мета-анализа коришћењем кетогене дијете на животињским моделима и у студијама на људима сугерише благотворан утицај на преживљавање, са користи које су проспективно повезане са величином кетозе, временом почетка дијете и локацијом тумора (Клемент ет ал., 2016; Воолф ет ал., 2016). Третман ћелија рака панкреаса кетонским тијелима (д-?ОХБ или АцАц) инхибира раст, пролиферацију и гликолизу, а кетогена дијета (81% кцал масти, 18% протеина, 1% угљених хидрата) смањује ин виво тежину тумора, гликемију и повећана мишићна и телесна тежина код животиња са имплантираним карциномом (Схукла ет ал., 2014). Слични резултати су примећени коришћењем модела ћелија метастатског глиобластома код мишева који су примали суплементацију кетонима у исхрани (Пофф ет ал., 2014). Супротно томе, кетогена дијета (91% кцал масти, 9% протеина) повећала је концентрацију ?ОХБ у циркулацији и смањила гликемију, али није имала утицај ни на запремину тумора ни на трајање преживљавања код пацова са глиомом (Де Феитер ет ал., 2016). Индекс глукозе кетона је предложен као клинички индикатор који побољшава метаболичко управљање терапијом рака мозга изазваном кетогеном исхраном код људи и мишева (Меиденбауер ет ал., 2015). Узети заједно, улоге метаболизма кетонских тела и кетонских тела у биологији рака су задивљујуће јер свака од њих представља терапијске опције које се могу решити, али основни аспекти тек треба да се разјасне, са јасним утицајима који произилазе из матрице варијабли, укључујући (и) разлике између егзогеног кетона тела наспрам кетогене дијете, (ии) тип ћелије рака, геномски полиморфизми, степен и стадијум; и (иии) време и трајање излагања кетотичном стању.

Кетогенезу стварају кетонска тела разградњом масних киселина и кетогених аминокиселина. Овај биохемијски процес даје енергију различитим органима, посебно мозгу, под условима поста, као одговор на недоступност глукозе у крви. Кетонска тела се углавном производе у митохондријима ћелија јетре. Иако су друге ћелије способне да изврше кетогенезу, оне у томе нису толико ефикасне као ћелије јетре. Пошто се кетогенеза јавља у митохондријима, њени процеси се регулишу независно. Др Алек Јименез ДЦ, ЦЦСТ Инсигхт
Терапијска примена кетогене дијете и егзогених кетонских тела
Примене кетогене дијете и кетонских тела као терапијских алата такође су се појавиле у не-канцерогеним контекстима, укључујући гојазност и НАФЛД/НАСХ (Бровнинг ет ал., 2011; Фостер ет ал., 2010; Сцхугар и Цравфорд, 2012); срчана инсуфицијенција (Хуинх, 2016; Колвицз ет ал., 2016; Таегтмеиер, 2016); неуролошке и неуродегенеративне болести (Мартин ет ал., 2016; МцНалли и Хартман, 2012; Рхо, 2015; Рогавски ет ал., 2016; Ианг и Цхенг, 2010; Иао ет ал., 2011); урођене грешке метаболизма (Сцхолл-Б�рги ет ал, 2015); и перформансе вежбања (Цок ет ал., 2016). Ефикасност кетогене дијете је посебно цењена у терапији епилептичких напада, посебно код пацијената резистентних на лекове. Већина студија је проценила кетогене дијете код педијатријских пацијената и открила до ~50% смањење учесталости напада након 3 месеца, уз побољшану ефикасност код одабраних синдрома (Ву ет ал., 2016б). Искуство је ограниченије код епилепсије одраслих, али је евидентно слично смањење, са бољим одговором код пацијената са симптоматском генерализованом епилепсијом (Неи ет ал., 2014). Основни антиконвулзивни механизми остају нејасни, иако претпостављене хипотезе укључују смањено коришћење глукозе/гликолизу, репрограмирани транспорт глутамата, индиректан утицај на АТП-осетљиве калијумове канале или аденозин А1 рецептор, промену експресије изоформе натријумовог канала или ефекте на лептин (хормоне у циркулацији, укључујући Ламбрецхтс ет ал., 2016; Лин ет ал., 2017; Лутас и Иеллен, 2013). Остаје нејасно да ли се антиконвулзивни ефекат првенствено може приписати кетонским телима или због каскадних метаболичких последица дијете са мало угљених хидрата. Ипак, чини се да кетонски естри (види доле) подижу праг напада на животињским моделима изазваних нападаја (Циарлоне ет ал., 2016; Д'Агостино ет ал., 2013; Виггиано ет ал., 2015).
Аткинсова и кетогена дијета са ниским садржајем угљених хидрата често се сматра непријатном и може изазвати затвор, хиперурикемију, хипокалцемију, хипомагнезијемију, довести до нефролитијазе, кетоацидозе, хипергликемије и повећати концентрацију холестерола и слободних масних киселина у циркулацији (Биссцхоп ет ал., 2001 ; Коссофф и Хартман, 2012; Квитеровицх и сар., 2003; Сузуки и сар., 2002). Из ових разлога дугорочно придржавање представља изазове. Студије на глодарима обично користе карактеристичну расподелу макронутријената (94% кцал масти, 1% кцал угљених хидрата, 5% кцал протеина, Био-Серв Ф3666), што изазива снажну кетозу. Међутим, повећање садржаја протеина, чак и до 10% кцал, у великој мери умањује кетозу, а ограничење протеина од 5% кцал даје нејасне метаболичке и физиолошке ефекте. Ова формулација дијете је такође осиромашена холином, што је друга променљива која утиче на осетљивост на повреду јетре, па чак и на кетогенезу (Гарбов ет ал., 2011; Јорнаиваз ет ал., 2010; Кеннеди ет ал., 2007; Писсиос ет ал., 2013; Сцхугар и сар., 2013). Ефекти дуготрајне конзумације кетогених дијета код мишева и даље су у потпуности дефинисани, али недавне студије на мишевима откриле су нормално преживљавање и одсуство маркера повреде јетре код мишева на кетогену дијету током њиховог живота, иако метаболизам аминокиселина, потрошња енергије и сигнализација инсулина били су изразито репрограмирани (Доурис и сар., 2015).
Механизми који повећавају кетозу путем механизама алтернативних кетогеним дијетама укључују употребу ингестибилних прекурсора кетонског тела. Примена егзогених кетонских тела могла би створити јединствено физиолошко стање какво се не може наћи у нормалној физиологији, јер су концентрације глукозе и инсулина у циркулацији релативно нормалне, док ћелије могу поштедети унос и употребу глукозе. Сама кетонска тела имају кратак полуживот, а гутање или инфузија натријум-ОХБ соли да би се постигла терапеутска кетоза изазива непријатно оптерећење натријумом. Р / С-1,3-бутандиол је нетоксични алкохол који се лако оксидира у јетри дајући д / 1992-АОХБ (Десроцхерс ет ал., XNUMX). У различитим експерименталним контекстима, ова доза се даје мишевима или пацовима свакодневно чак седам недеља, дајући циркулишуће концентрације? ОХБ до 5 мМ у року од 2 сата од примене, што је стабилно најмање додатних 3 сата (Д ' Агостино и сар., 2013). Делимично сузбијање уноса хране примећено је код глодара којима је даван Р / С-1,3-бутандиол (Царпентер и Гроссман, 1983). Поред тога, три хемијски различита кетонска естра (КЕ), (и) моноестер Р-1,3-бутандиола и д-ОХБ (Р-3-хидроксибутил Р-ОХБ); (ии) глицерил-трис-? ОХБ; и (иии) Р, С-1,3-бутандиол ацетоацетат диестер, такође су опсежно проучавани (Бруненграбер, 1997; Цларке и сар., 2012а; Цларке и сар., 2012б; Десроцхерс и сар., 1995а; Десроцхерс и сар. ., 1995б; Касхиваиа и сар., 2010). Инхерентна предност првог је да се 2 мола физиолошког д-? ОХБ производе по молу КЕ, након хидролизе естеразе у цревима или јетри. Сигурност, фармакокинетика и толеранција су најопсежније проучавани код људи који уносе Р-3-хидроксибутил Р-? ОХБ, у дозама до 714 мг / кг, дајући концентрације д-? ОХБ у циркулацији до 6 мМ (Цларке ет ал., 2012а; Цок и сар., 2016; Кемпер и сар., 2015; Схивва и сар., 2016). Код глодара, ова КЕ смањује унос калорија и укупни холестерол у плазми, стимулише смеђе масно ткиво и побољшава резистенцију на инсулин (Касхиваиа и сар., 2010; Кемпер и сар., 2015; Веецх, 2013). Новија сазнања указују да је током вежбања код тренираних спортиста гутање Р-3-хидроксибутил Р-? ОХБ смањило гликолизу скелетних мишића и концентрацију лактата у плазми, повећало интрамускуларну оксидацију триацилглицерола и очувало садржај гликогена у мишићима, чак и када је заједнички унос угљених хидрата стимулисао секрецију инсулина ( Цок и сар., 2016). Потребан је даљи развој ових интригантних резултата, јер је побољшање перформанси вежбања издржљивости углавном било вођено снажним одговором на КЕ код 2/8 испитаника. Без обзира на то, ови резултати подржавају класичне студије које указују на предност оксидацији кетона у односу на друге подлоге (ГАРЛАНД и сар., 1962; Хасселбаинк и сар., 2003; Станлеи и сар., 2003; Валенте-Силва и сар., 2015), укључујући и током вежбања, и да тренирани спортисти могу бити спремнији да користе кетоне (Јохнсон и сар., 1969а; Јохнсон и Валтон, 1972; Виндер и сар., 1974; Виндер и сар., 1975). Коначно, механизми који могу подржати побољшане перформансе вежбања након једнаког уноса калорија (различито распоређених међу макронутријентима) и једнаке стопе потрошње кисеоника тек треба да се утврде.
Будућа перспектива
Некада у великој мери стигматизован као пут преливања способан да акумулира токсичне емисије из сагоревања масти у ограниченим стањима угљених хидрата ("кетотоксична" парадигма), недавна запажања подржавају идеју да метаболизам кетонских тела служи спасоносној улози чак и у стањима пуним угљених хидрата, отварајући "кетохорметик". � хипотеза. Док лаки нутритивни и фармаколошки приступи за манипулисање метаболизмом кетона чине га атрактивном терапијском метом, агресивно постављени, али разборити експерименти остају иу основним и транслационим истраживачким лабораторијама. Незадовољене потребе су се појавиле у доменима дефинисања улоге утицаја метаболизма кетона код срчане инсуфицијенције, гојазности, НАФЛД/НАСХ, дијабетеса типа 2 и рака. Обим и утицај "неканонских" сигналних улога кетонских тела, укључујући регулацију ПТМ-а који се вероватно враћају назад и напред у метаболичке и сигналне путеве, захтевају дубље истраживање. Коначно, екстрахепатична кетогенеза би могла да отвори интригантне паракрине и аутокрине сигналне механизме и могућности да утиче на ко-метаболизам унутар нервног система и тумора како би се постигли терапијски циљеви.
priznanja
Нцби.нлм.них.гов/пмц/артицлес/ПМЦ5313038/
Фусноте
У закључку, кетонска тела ствара јетра да би се користила као извор енергије када у људском телу нема довољно глукозе. Кетогенеза се јавља када су нивои глукозе у крви ниски, посебно након што су друге ћелијске залихе угљених хидрата исцрпљене. Сврха горњег чланка била је да се дискутује о вишедимензионалној улози кетонских тела у метаболизму горива, сигнализацији и терапији. Обим наших информација је ограничен на киропрактику и здравствене проблеме кичме. Да бисте разговарали о овој теми, слободно питајте др Хименеза или нас контактирајте на�915-850-0900 .
Курирао др Алек Јименез
Референтно са:�Нцби.нлм.них.гов/пмц/артицлес/ПМЦ5313038/

Додатна тема: �Акутни бол у леђима
Бол у леђима�један од најчешћих узрока инвалидитета и пропуштених дана на послу широм света. Бол у леђима приписује другом најчешћем разлогу посета лекару, надмашују га само инфекције горњих дисајних путева. Отприлике 80 процената популације искусиће бол у леђима бар једном током свог живота. Кичма је сложена структура коју чине кости, зглобови, лигаменти и мишићи, између осталих меких ткива. Повреде и/или отежана стања, као што је�хернија дискова, може на крају довести до симптома болова у леђима. Спортске повреде или повреде у саобраћајним незгодама често су најчешћи узрок болова у леђима, међутим, понекад најједноставнији покрети могу имати болне последице. На срећу, алтернативне опције лечења, као што је киропрактичка нега, могу помоћи у ублажавању болова у леђима коришћењем подешавања кичме и ручних манипулација, што на крају побољшава ублажавање болова. �

ЕКСТРА ЕКСТРА | ВАЖНА ТЕМА: Препоручени Ел Пасо, ТКС Цхиропрацтор
***
Информације овде о „Вишедимензионалне улоге кетонских тела" није намењен да замени однос један на један са квалификованим здравственим радником или лиценцираним лекаром и није медицински савет. Подстичемо вас да доносите одлуке о здравственој заштити на основу вашег истраживања и партнерства са квалификованим здравственим радником.
Информације о блогу и дискусије о обиму
Наш обим информација је ограничен на киропрактику, мускулоскелетну, физикалне лекове, веллнесс, доприносећи етиолошкој висцеросоматски поремећаји унутар клиничких презентација, повезане клиничке динамике соматовисцералног рефлекса, комплекса сублуксације, осетљивих здравствених проблема и/или чланака, тема и дискусија функционалне медицине.
Пружамо и представљамо клиничка сарадња са специјалистима из разних дисциплина. Сваки специјалиста се руководи својим професионалним обимом праксе и јурисдикцијом лиценцирања. Користимо функционалне здравствене и веллнесс протоколе за лечење и подршку нези повреда или поремећаја мишићно-скелетног система.
Наши видео снимци, постови, теме, теме и увиди покривају клиничка питања, проблеме и теме које се односе на и директно или индиректно подржавају наш клинички обим праксе.*
Наша канцеларија је разумно покушала да обезбеди цитате у прилог и идентификовала је релевантну истраживачку студију или студије које подржавају наше објаве. На захтев пружамо копије пратећих истраживачких студија доступне регулаторним одборима и јавности.
Разумемо да покривамо питања која захтевају додатно објашњење како то може помоћи у одређеном плану неге или протоколу лечења; зато, да бисте даље разговарали о горњој теми, слободно питајте Др Алек Јименез, ДЦ, или нас контактирајте 915-850-0900.
Овде смо да помогнемо вама и вашој породици.
Благослови
Др. Алек Јименез ДЦ, МСАЦП, РН*, ЦЦСТ, ИФМЦП*, ЦИФМ*, АТН*
e-маил: цоацх@елпасофунцтионалмедицине.цом
Лиценцирани као доктор киропрактике (ДЦ) у Тексас & Нови Мексико*
Тексас ДЦ лиценца бр. ТКСКСНУМКС, Нев Мекицо ДЦ Лиценца # НМ-ДЦ2182
Лиценцирана као медицинска сестра (РН*) in Флорида
Флорида лиценца РН лиценца # РНКСНУМКС (Контролни бр. 3558029)
Компактни статус: Вишедржавна лиценца: Овлашћени за праксу у КСНУМКС државе*
Др Алек Јименез ДЦ, МСАЦП, РН* ЦИФМ*, ИФМЦП*, АТН*, ЦЦСТ
Моја дигитална визит карта