1. ВХО. ВХО | Прекомерна тежина и гојазност. ввв.вхо.инт/гхо/нцд/
риск_фацторс/овервеигхт/ен/индек.хтмл. Приступљено 29. јануара 2015.
2. Виссцхер ПМ, Бровн МА, МцЦартхи МИ, Ианг Ј. Пет година открића ГВАС.
Ам Ј Хум Генет. 2012;90:7�24.
3. Лоцке АЕ, Кахали Б, Берндт СИ, Јустице АЕ, Перс ТХ, Даи ФР, ет ал. Генетски
студије индекса телесне масе дају нове увиде у биологију гојазности. Природа.
2015;518:197�206.
4. Линг Ц, Дел Гуерра С, Лупи Р, Рнн Т, Гранхалл Ц, Лутхман Х, ет ал.
Епигенетска регулација ППАРГЦ1А у хуманим дијабетичким острвима типа 2 и
утицај на лучење инсулина. Диабетологиа. 2008;51:615�22.
5. Ван Дијк СЈ, Моллои ПЛ, Варинли Х, Моррисон ЈЛ, Мухлхауслер БС. Епигенетика
и људска гојазност. Инт Ј Обес (Лонд). 2015;39:85�97.
6. Тех АЛ, Пан Х, Цхен Л, Онг МЛ, Догра С, Вонг Ј, ет ал. Ефекат
генотип и ин утеро окружење на интериндивидуалне варијације код новорођенчета
ДНК метиломи. Геноме Рес. 2014;24:1064�74.
7. Олссон АХ, Волков П, Бацос К, Даиех Т, Халл Е, Нилссон ЕА, ет ал. Геномевиде
повезаности између утицаја генетске и епигенетске варијације
експресија мРНА и секреција инсулина у људским острвцима панкреаса. ПЛоС
Генет. 2014;10:е1004735.
8. Грундберг Е, Медури Е, Сандлинг ЈК, Хедман АК, Кеилдсон С, Буил А, ет ал.
Глобална анализа варијације метилације ДНК у масном ткиву близанаца
открива везе са варијантама повезаним са болестима у дисталним регулаторним елементима.
Ам Ј Хум Генет. 2013;93:876�90.
9. Ронн Т, Волков П, Гиллберг Л, Кокосар М, Перфилиев А, Јацобсен АЛ, ет ал.
Утицај старости, БМИ и нивоа ХбА1ц на ДНК у целом геному
метилација и обрасци експресије мРНК у људском масном ткиву
и идентификацију епигенетских биомаркера у крви. Хум Мол Генет.
2015;24:3792�813.
10. Ватерланд РА, Мицхелс КБ. Епигенетска епидемиологија развоја
хипотеза о пореклу. Анну Рев Нутр. 2007;27:363�88.
11. МцМиллен ИЦ, Раттанатраи Л, Дуффиелд ЈА, Моррисон ЈЛ, МацЛаугхлин СМ, Гентили
С, ет ал. Рано порекло касније гојазности: путеви и механизми. Адв
Екп Мед Биол. 2009;646:71�81.
12. Равелли А, ван дер Меулен Ј, Мицхелс Р, Осмонд Ц, Баркер Д, Халес Ц, ет ал.
Толеранција на глукозу код одраслих након пренаталног излагања глади. Ланцет.
1998;351:173�7.
13. МцМиллен ИЦ, МацЛаугхлин СМ, Мухлхауслер БС, Гентили С, Дуффиелд ЈЛ,
Моррисон ЈЛ. Развојно порекло здравља и болести одраслих: улога
периконцепцијска и фетална исхрана. Басиц Цлин Пхармацол Токицол.
2008;102:82�9.
14. Зханг С, Раттанатраи Л, МцМиллен ИЦ, Сутер ЦМ, Моррисон ЈЛ. Перицонцептионал
исхрана и рано програмирање живота у гојазности или невољама. Прог
Биопхис Мол Биол. 2011;106:307�14.
15. Боурет С, Левин БЕ, Озанне СЕ. Контролисање интеракција ген-средина
хомеостаза енергије и глукозе и развојно порекло гојазности.
Пхисиол Рев. 2015; 95:47�82.
16. Боренгассер СЈ, Зхонг И, Канг П, Линдсеи Ф, Ронис МЈ, Бадгер ТМ, ет ал.
Гојазност мајке повећава диференцијацију белог масног ткива и мења
метилација ДНК на нивоу генома код потомака мушких пацова. Ендоцринологи.
2013;154:4113�25.
17. Глуцкман ПД, Лиллицроп КА, Вицкерс МХ, Плеасантс АБ, Пхиллипс ЕС, Беедле АС,
ет ал. Метаболичка пластичност током развоја сисара је усмерена
зависи од раног статуса ухрањености. Проц Натл Ацад Сци УС А.
2007;104:12796�800.
18. Годфри КМ, Схеппард А, Глуцкман ПД, Лиллицроп КА, Бурдге ГЦ, МцЛеан Ц,
ет ал. Метилација епигенетског промотора гена при рођењу је повезана са
каснија адипозност детета. дијабетеса. 2011;60:1528�34.
19. МцМиллен ИЦ, Адам ЦЛ, Мухлхауслер БС. Рани извори гојазности:
програмирање регулаторног система апетита. Ј Пхисиол. 2005;565(Пт 1):9�17.
20. Бегум Г, Стевенс А, Смитх ЕБ, Цоннор К, Цхаллис ЈР, Блоомфиелд Ф, ет ал.
Епигенетске промене у путевима регулације енергије хипоталамуса фетуса су
повезана са неухрањеношћу мајке и братимљењем. ФАСЕБ Ј.
2012;26:1694�703.
21. Ге ЗЈ, Лианг ККС, Хоу И, Хан ЗМ, Сцхаттен Х, Сун КИ, ет ал. Гојазност мајке
и дијабетес може изазвати промену метилације ДНК у сперматозоидима
потомство код мишева. Репрод Биол Ендоцринол. 2014;12:29.
22. Јоуссе Ц, Парри Л, Ламберт-Ланглаис С, Маурин АЦ, Авероус Ј, Брухат А, ет ал.
Перинатална потхрањеност утиче на метилацију и експресију лептина
ген код одраслих: импликација за разумевање метаболичког синдрома.
ФАСЕБ Ј. 2011;25:3271�8.
23. Лан Кс, Цретнеи ЕЦ, Кропп Ј, Кхатееб К, Берг МА, Пенагарицано Ф, ет ал.
Исхрана мајке током трудноће индукује експресију гена и ДНК
промене метилације у ткивима фетуса код оваца. Фронт Генет. 2013;4:49.
24. Ли ЦЦ, Иоунг ПЕ, Малонеи ЦА, Еатон СА, Цовлеи МЈ, Буцкланд МЕ, ет ал.
Гојазност и дијабетес код мајке изазивају латентне метаболичке дефекте и
распрострањене епигенетске промене код изогених мишева. Епигенетика. 2013;8:602�11.
25. Лиллицроп КА, Пхиллипс ЕС, Јацксон АА, Хансон МА, Бурдге ГЦ. Дијететски протеини
ограничење трудних пацова индукује, а суплементација фолне киселине спречава
епигенетска модификација експресије хепатичких гена у потомству. Ј Нутр.
2005;135:1382�6.
26. Радфорд ЕЈ, Ито М, Схи Х, Цорисх ЈА, Иамазава К, Исганаитис Е, ет ал. У материци
ефекти. Ин утеро потхрањеност ремети метилом сперме одраслих
и међугенерацијски метаболизам. Наука. 2014;345(80):1255903.
27. Сутер М, Боцоцк П, Сховалтер Л, Ху М, Схопе Ц, МцКнигхт Р, ет ал.
Епигеномика: излагање мајчиној исхрани са високим садржајем масти у материци ремети
периферна циркадијална експресија гена код нељудских примата. ФАСЕБ Ј.
2011;25:714�26.
28. Сутер МА, Ма Ј, Вугуин ПМ, Хартил К, Фиалло А, Харрис РА, ет ал. У материци
излагање мајчиној исхрани са високим садржајем масти мења епигенетски хистонски код у а
мишји модел. Ам Ј Обс Гинецол. 2014;210:463 е1�463 е11.
29. Тосх ДН, Фу К, Цаллаваи ЦВ, МцКнигхт РА, МцМиллен ИЦ, Росс МГ, ет ал.
Епигенетика програмиране гојазности: промена у ИУГР јетреном ИГФ1 пацова
експресија мРНК и хистонска структура у брзом у односу на одложено постнатално
сустизање раста. Ам Ј Пхисиол Гастроинтест Физиол јетре.
2010;299:Г1023�9.
30. Сандовићи И, Смитх НХ, Нитерт МД, Ацкерс-Јохнсон М, Урибе-Левис С, Ито И,
ет ал. Исхрана мајке и старење мењају епигенетску контролу промотера
интеракција на гену Хнф4а у острвцима панкреаса пацова. Проц Натл
Ацад Сци УС А. 2011;108:5449�54.
31. Браунсцхвеиг М, Јаганнатхан В, Гутзвиллер А, Бее Г. Истраживања о
трансгенерацијски епигенетски одговор по мушкој линији код Ф2 свиња. ПЛоС
Једно. 2012;7, е30583.
32. Цароне БР, Фаукуиер Л, Хабиб Н, Схеа ЈМ, Харт ЦЕ, Ли Р, ет ал. очински
индуковано трансгенерацијско репрограмирање животне средине метаболичких
експресија гена код сисара. Ћелија. 2010;143:1084�96.
33. Ост А, Лемпрадл А, Цасас Е, Веигерт М, Тико Т, Дениз М, ет ал. Очева дијета
дефинише стање хроматина потомства и међугенерацијску гојазност. Ћелија.
2014;159:1352�64.
34. Мартенез Д, Пентинат Т, Рибс С, Давиауд Ц, Блокс ВВ, Цебри Ј, ет ал. У материци
потхрањеност код мужјака мишева програмира метаболизам липида у јетри у другој генерацији
потомство које укључује измењену метилацију Лкра ДНК. Целл Метаб.
2014;19:941�51.
35. Веи И, Ианг ЦР, Веи ИП, Зхао ЗА, Хоу И, Сцхаттен Х, ет ал. очински
индуковано трансгенерацијско наслеђивање подложности дијабетесу у
сисара. Проц Натл Ацад Сци УС А. 2014;111:1873�8.
36. Гроссниклаус У, Келли ВГ, Келли Б, Фергусон-Смитх АЦ, Пембреи М, Линдкуист
С. Трансгенерацијско епигенетско наслеђе: колико је важно? Нат Рев
Генет. 2013;14:228�35.
37. Пембреи М, Саффери Р, Бигрен ЛО. Људски трансгенерацијски одговори на
искуство у раном животу: потенцијални утицај на развој, здравље и
биомедицинска истраживања. Ј Мед Генет. 2014;51:563�72.
38. Волфф ГЛ, Коделл РЛ, Мооре СР, Цоонеи ЦА. Епигенетика мајке и метил
суплементи утичу на експресију агоути гена код Ави/а мишева. ФАСЕБ Ј.
1998;12:949�57.
39. Јиртле РЛ, Скиннер МК. Епигеномика животне средине и осетљивост на болести.
Нат Рев Генет. 2007;8:253�62.
40. Морган ХД, Сутхерланд ХГ, Мартин ДИ, Вхителав Е. Епигенетичко наслеђе у
агоути локус код миша. Нат Генет. 1999;23:314�8.
41. Цроплеи ЈЕ, Сутер ЦМ, Бецкман КБ, Мартин ДИ. Епигенетика заметне линије
модификација мишјег А в алела додатком исхрани. Проц
Натл Ацад Сци УС А. 2006;103:17308�12.
42. Хоиле СП, Лиллицроп КА, Тхомас НА, Хансон МА, Бурдге ГЦ. Дијететски протеини
ограничење током Ф0 трудноће код пацова изазива трансгенерацијске промене у
транскриптом јетре код женског потомства. ПЛоС Оне. 2011;6, е21668.
43. Мултхауп МЛ, Селдин ММ, Јаффе АЕ, Леи Кс, Кирцхнер Х, Мондал П, ет ал. Моусехуман
експериментална епигенетска анализа разоткрива мете у исхрани и
генетска одговорност за дијабетичке фенотипове. Целл Метаб. 2015;21:138�49.
44. Мицхелс КБ, Биндер АМ, Дедеурваердер С, Епстеин ЦБ, Греалли ЈМ, Гут И, ет ал.
Препоруке за дизајн и анализу епигенома широм света
студије асоцијација. Нат Метходс. 2013;10:949�55.
45. Даиех ТА, Олссон АХ, Волков П, Алмгрен П, Рнн Т, Линг Ц. Идентификација
ЦпГ-СНП-ови повезани са дијабетесом типа 2 и диференцијалном метилацијом ДНК
у људским острвцима панкреаса. Диабетологиа. 2013;56:1036�46.
46. Релтон ЦЛ, Давеи Смитх Г. Двостепена епигенетска менделска рандомизација: а
стратегија за утврђивање узрочне улоге епигенетских процеса у путевима
до болести. Инт Ј Епидемиол. 2012;41:161�76.
47. Лиу И, Ариее МЈ, Падиуков Л, Фаллин МД, Хесселберг Е, Рунарссон А, ет ал.
Подаци о повезаности широм епигенома имплицирају метилацију ДНК као ан
посредник генетског ризика код реуматоидног артритиса. Нат Биотецхнол.
2013;31:142�7.
48. Иуан В, Ксиа И, Белл ЦГ, Иет И, Ферреира Т, Вард КЈ, ет ал. Интегрисани
епигеномска анализа за локусе осетљивости на дијабетес типа 2 код монозигота
близанци. Нат Цоммун. 2014;5:5719.
49. Нитерт МД, Даиех Т, Волков П, Елгзири Т, Халл Е, Нилссон Е, ет ал. Утицај ан
вежба интервенција на метилацији ДНК у скелетним мишићима од првог степена
рођаци пацијената са дијабетесом типа 2. дијабетеса. 2012;61:3322�32.
50. Гагнон Ф, Асси Д, Царри� А, Моранге ПЕ, Тргут ДА. Робусна валидација
повезаност нивоа метилације на локусу ЦПТ1А са нивоима липида у плазми.
Ј Липид Рес. 2014;55:1189�91.
51. Демератх ЕВ, Гуан В, Грове МЛ, Аслибекиан С, Менделсон М, Зхоу ИХ,
ет ал. Епигеномска асоцијацијска студија (ЕВАС) БМИ, промене БМИ и
обим струка код одраслих Афроамериканаца идентификује вишеструко реплицирано
лоци. Хум Мол Генет. 2015:ддв161�.
52. Дицк КЈ, Нелсон ЦП, Тсапроуни Л, Сандлинг ЈК, Асси Д, Вахл С, ет ал. ДНК
метилација и индекс телесне масе: анализа на нивоу генома. Ланцет.
2014;6736:1�9.
53. Су С, Зху Х, Ксу Кс, Ванг Кс, Донг И, Капуку Г, ет ал. ДНК метилација од
ЛИ86 ген је повезан са гојазношћу, инсулинском резистенцијом и
упала. Твин Рес Хум Генет. 2014;17:183�91.
54. Цларке-Харрис Р, Вилкин ТЈ, Хоскинг Ј, Пинкнеи Ј, Јеффери АН, Метцалф БС, ет ал.
ПГЦ1? метилација промотера у крви на 5 година предвиђа адипозност од
9 до 14 година (ЕарлиБирд 50). дијабетеса. 2014;63:2528�37.
55. Гуаи СП, Бриссон Д, Ламарцхе Б, Бирон С, Лесцеллеур О, Биертхо Л, ет ал.
АДРБ3 ген промотер ДНК метилација у крви и висцералној масноћи
ткива је повезана са метаболичким поремећајима код мушкараца. Епигеномика.
2014;6:33�43.
56. Агха Г, Хоусеман ЕА, Келсеи КТ, Еатон ЦБ, Бука СЛ, Лоуцкс ЕБ. Масноћа је
повезан са профилом метилације ДНК у масном ткиву. Инт Ј Епидемиол.
2014:1�11.
57. Ирвин МР, Зхи Д, Јоеханес Р, Менделсон М, Аслибекиан С, Цлаас СА, ет ал.
Студија асоцијације на епигеноме липида у крви наташте у генетици
лекови за снижавање липида и студија мреже о исхрани. Циркулација. 2014;130:565�72.
58. Фразиер-Воод АЦ, Аслибекиан С, Абсхер ДМ, Хопкинс ПН, Сха Ј, Тсаи МИ, ет ал.
Метилација на ЦПТ1А локусу је повезана са субфракцијом липопротеина
профили. Ј Липид Рес. 2014;55:1324�30.
59. Пфеифферм Л, Вахл С, Пиллинг ЛЦ, Реисцхл Е, Сандлинг ЈК, Кунзе С, ет ал. ДНК
метилација гена повезаних са липидима утиче на ниво липида у крви. Цирц Цардиовасц
Генет. 2015.
60. Петерсен АК, Зеилингер С, Кастенмллер Г, Римисцх-Маргл В, Бруггер М, Петерс
А, ет ал. Епигенетика се сусреће са метаболомиком: асоцијација на целом епигеному
студија са метаболичким особинама крвног серума. Хум Мол Генет. 2014;23:534�45.
61. Хидалго Б, Ирвин МР, Сха Ј, Зхи Д, Аслибекиан С, Абсхер Д, ет ал. Епигеномевиде
асоцијацијска студија мерења глукозе, инсулина и ХОМА-ИР наташте
у генетици лекова за снижавање липида и проучавању мреже исхране. дијабетеса.
2014;63:801�7.
62. Даиех Т, Волков П, Салс С, Халл Е, Нилссон Е, Олссон АХ, ет ал. Широм генома
Анализа метилације ДНК људских острваца панкреаса код дијабетичара типа 2
а донатори без дијабетеса идентификују гене кандидате који утичу на инсулин
секреција. ПЛоС Генет. 2014;10, е1004160.
63. Нилссон Е, Јанссон ПА, Перфилиев А, Волков П, Педерсен М, Свенссон МК, ет ал.
Измењена метилација ДНК и диференцијална експресија утицаја гена
метаболизам и запаљење у масном ткиву код испитаника типа 2
дијабетеса. дијабетеса. 2014;63:2962�76.
64. Бентон МЦ, Јохнстоне А, Еццлес Д, Хармон Б, Хаиес МТ, Леа РА, ет ал. Анализа метилације ДНК у људском масном ткиву открива диференцијалну модификацију гена гојазности пре и после гастричног бајпаса и тежине
губитак. Гене. 2015;16:1�21.
65. Батесон П, Глуцкман П. Пластичност и робусност у развоју и
еволуција. Инт Ј Епидемиол. 2012;41:219�23.
66. Феинберг АП, Иризарри РА, Феинберг АП, Иризарри РА. Еволуција у здрављу и
медицина Сацклер колоквијум: стохастичка епигенетска варијација као покретачка
сила развоја, еволуциона адаптација и болест. Проц Натл Ацад
Сци УС А. 2010;107(Суппл):1757�64.
67. Мартино Д, Локе ИЈ, Гордон Л, Олликаинен М, Цруицксханк МН, Саффери Р, ет ал.
Лонгитудинална анализа метилације ДНК код близанаца од рођења на нивоу генома
до 18 месеци живота открива брзе епигенетске промене у раном животу и специфичне за пар
ефекти несклада. Геноме Биол. 2013;14:Р42.
68. Тоби ЕВ, Гоеман ЈЈ, Монајеми Р, Гу Х, Путтер Х, Зханг И, ет ал. ДНК
потписи метилације повезују излагање пренаталној глади са растом и
метаболизам. Нат Цоммун. 2014;5:5592.
69. Домингуез-Салас П, Мооре СЕ, Бакер МС, Берген АВ, Цок СЕ, Диер РА, ет ал.
Исхрана мајке при зачећу модулира метилацију ДНК човека
метастабилне епиалеле. Нат Цоммун. 2014;5:3746.
70. Куилтер ЦР, Цоопер ВН, Цлиффе КМ, Скиннер БМ, Прентице ПМ, Нелсон Л, ет ал.
Утицај на обрасце метилације потомака гестационог дијабетеса мајке
мелитус и интраутерино ограничење раста сугеришу заједничке гене и
путеви повезани са каснијим ризиком од дијабетеса типа 2. ФАСЕБ Ј. 2014: 1�12.
71. Моралес Е, Гроом А, Лавлор ДА, Релтон ЦЛ. Потписи метилације ДНК у
Крв из пупчане врпце повезана са гестацијским повећањем телесне тежине мајке: резултати од
АЛСПАЦ кохорта. БМЦ Рес Нотес. 2014;7:278.
72. Руцхат СМ, Хоуде АА, Воисин Г, Ст-Пиерре Ј, Перрон П, Баилларгеон ЈП, ет ал.
Гестацијски дијабетес мелитус епигенетски утиче претежно на гене
укључени у метаболичке болести. Епигенетика. 2013;8:935�43.
73. Лиу Кс, Цхен К, Тсаи ХЈ, Ванг Г, Хонг Кс, Зхоу И, ет ал. Матернал
индекс телесне масе пре зачећа и ДНК крви пупчаника потомства
метилација: истраживање раног животног порекла болести. Енвирон Мол
Мутаген. 2014;55:223�30.
74. Соубри А, Мурпхи СК, Ванг Ф, Хуанг З, Видал АЦ, Фуеммелер БФ, ет ал.
Новорођенчад гојазних родитеља су променила обрасце метилације ДНК код
утиснутих гена. Инт Ј Обес (Лонд). 2015;39:650�7.
75. Јацобсен СЦ, Брнс Ц, Борк-Јенсен Ј, Рибел-Мадсен Р, Ианг Б, Лара Е, ет ал.
Ефекти краткорочног прекомерног храњења са високим садржајем масти на ДНК у целом геному
метилације у скелетним мишићима здравих младића. Диабетологиа.
2012;55:3341�9.
76. Гиллберг Л, Јацобсен СЦ, Р�нн Т, Бр�нс Ц, Вааг А. ППАРГЦ1А ДНК
метилација у поткожном масном ткиву код субјеката са малом порођајном тежином
утицај 5 дана прекомерног храњења са високим садржајем масти. Метаболизам. 2014;63:263�71.
77. Хуанг ИТ, Маццани ЈЗЈ, Хавлеи НЛ, Винг РР, Келсеи КТ, МцЦаффери ЈМ.
Епигенетски обрасци код успешних одржавалаца губитка тежине: пилот студија. Инт Ј
Обес (Лонд). 2015;39:865�8.
78. Баррес Р, Кирцхнер Х, Расмуссен М, Иан Ј, Кантор ФР, Кроок А, Нслунд Е,
Зиерат ЈР. Губитак тежине након операције желучане премоснице код гојазности код људи
ремоделира промотор метилације. Целл Реп. 2013: 1�8.
79. Ахренс М, Аммерпохл О, вон Сцхонфелс В, Коларова Ј, Бенс С, Итзел Т, ет ал.
Анализа метилације ДНК у неалкохолној масној болести јетре сугерише
изразити потписи специфични за болест и ремоделирање након баријатријске хирургије.
Целл Метаб. 2013;18:296�302.
80. Воисин С, Еинон Н, Иан Кс, Бисхоп ДЈ. Вежбање и метилација ДНК
код људи. Ацта Пхисиол (Окф). 2014;213:39�59.
81. Линдхолм МЕ, Марабита Ф, Гомез-Кабреро Д, Рундквист Х, Екстрем ТЈ,
Тегнар Ј, ет ал. Интегративна анализа открива координисано репрограмирање
епигенома и транскриптома у људским скелетним мишићима после
обука. Епигенетика. 2014;9:1557�69.
82. Денхам Ј, О'Бриен БЈ, Маркуес ФЗ, Цхарцхар ФЈ. Промене у леукоциту
метилом и његов ефекат на гене повезане са кардиоваскуларним системом након вежбања.
Ј Аппл Пхисиол. 2014:јап.00878.2014.
83. Ровландс ДС, Паге РА, Сукала ВР, Гири М, Гхимбовсцхи СД, Хаиат И, ет ал.
Мулти-омске интегрисане мреже повезују метилацију ДНК и миРНА са
пластичност скелетних мишића до хроничног вежбања код дијабетичке гојазности типа 2.
Пхисиол Геномицс. 2014;46:747�65.
84. Хорватх С, Ерхарт В, Бросцх М, Аммерпохл О, вон Сцхонфелс В, Аренс М,
ет ал. Гојазност убрзава епигенетско старење људске јетре. Проц Натл Ацад
Сци. 2014;111:15538�43.
85. Алмн МС, Нилссон ЕК, Јацобссон ЈА, Калнина И, Кловинс Ј, Фредрикссон Р, ет ал.
Анализа на нивоу генома открива маркере метилације ДНК који варирају са
и старости и гојазности. Гене. 2014.;548:61�7
86. Хоусеман ЕА, Молитор Ј, Марсит ЦЈ. Подешавање мешавине ћелија без референци
у анализи података о метилацији ДНК. Биоинформатика. 2014;30:1431�9.
87. Веллс ЈЦ. Критичка процена хипотезе предиктивног адаптивног одговора.
Инт Ј Епидемиол. 2012;41:229�35.
88. Виллиамс-Висс О, Зханг С, МацЛаугхлин СМ, Клееманн Д, Валкер СК, Сутер
ЦМ, ет ал. Број ембриона и периконцепцијска потхрањеност у
овце имају различите ефекте на епигенотип надбубрежне жлезде, раст и
развој. Ам Ј Пхисиол Ендоцринол Метаб. 2014;307:Е141�50.
89. Зханг С, Раттанатраи Л, Моррисон ЈЛ, Ницхолас ЛМ, Лие С, МцМиллен ИЦ.
Гојазност мајке и рани извори гојазности у детињству: мерење тежине
користи и трошкови губитка тежине мајке у периконцепцији
период за потомство. Екп Диабетес Рес. 2011;2011:585749.
90. Зханг С, Виллиамс-Висс О, МацЛаугхлин СМ, Валкер СК, Клееманн ДО, Сутер
ЦМ, ет ал. Неухрањеност мајке током прве недеље након зачећа
резултира смањеном експресијом мРНК глукокортикоидног рецептора у
одсуство хиперметилације ГР ексона 17 у феталној хипофизи у кас
гестације. Ј Дев Ориг Хеал Дис. 2013;4:391�401.
91. Лие С, Моррисон ЈЛ, Виллиамс-Висс О, Сутер ЦМ, Хумпхреис ДТ, Озанне СЕ,
ет ал. Периконцепцијски програми потхрањености мењају инсулинску сигнализацију
молекуле и микроРНК у скелетним мишићима код једноплодног и близаначког фетуса
овце. Биол Репрод. 2014;90:5.
92. Ван Стратен ЕМ, ван Меер Х, Хуијкман НЦ, ван Дијк ТХ, Баллер ЈФ, Веркаде
ХЈ, ет ал. Активација Кс рецептора јетре фетуса акутно индукује липогенезу, али
не утиче на одговор липида у плазми на исхрану са високим садржајем масти код одраслих мишева. Ам Ј
Пхисиол Ендоцринол Метаб. 2009;297:Е1171�8.
93. Фернандез-Твин ДС, Алфарадхи МЗ, Мартин-Гронерт МС, Дукуе-Гимараес
ДЕ, Пиекарз А, Ферланд-МцЦоллоугх Д, ет ал. Смањење регулације ИРС-1 ин
масно ткиво потомака гојазних мишева је програмирано ћелијски аутономно
путем пост-транскрипционих механизама. Мол Метаб.
2014;3:325�33.
94. Ватерланд РА, Трависано М, Тахилиани КГ. Хиперметилација изазвана исхраном при
агоути виабле иеллов се не наслеђује трансгенерационо преко женке.
ФАСЕБ Ј. 2007;21:3380�5.
95. Ге ЗЈ, Луо СМ, Лин Ф, Лианг ККС, Хуанг Л, Веи ИЦ, ет ал. Метилација ДНК у
ооцити и јетра женки мишева и њихових потомака: ефекти дијета са високим садржајем масти
гојазност. Енв Хеал Перспецт. 2014;122:159�64.
96. Олликаинен М, Исмаил К, Гервин К, Килл�нен А, Хаккараинен А, Лундбом Ј, ет ал.
Промене метилације ДНК у крви на нивоу генома на регулаторним елементима
и хетерохроматске регије код монозиготних близанаца нескладне за гојазност
и масти јетре. Цлин Епигенетицс. 2015;7:1�13.




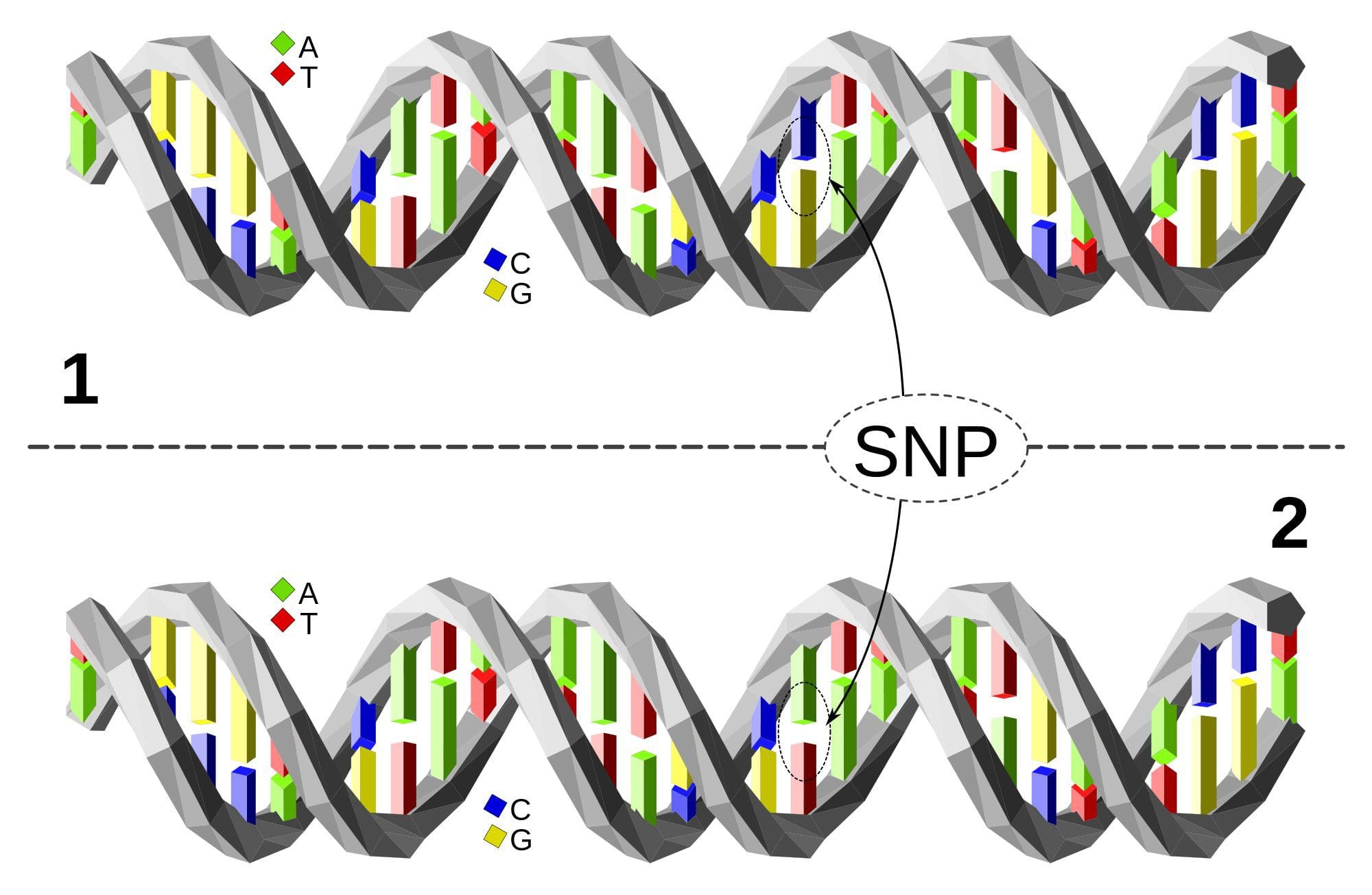
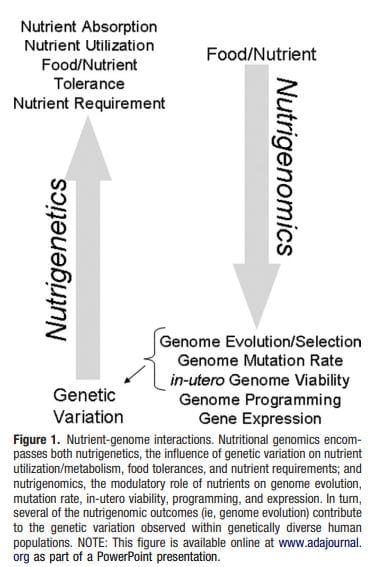




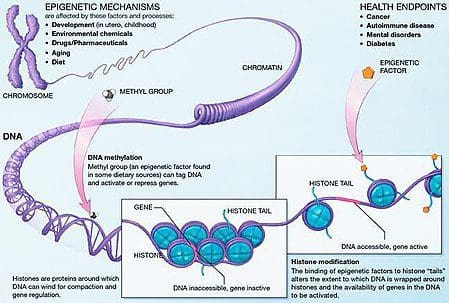 Гојазност је сложена, мултифакторска болест, а боље разумевање механизама који леже у основи интеракције између начина живота, животне средине и генетике је кључно за развој ефикасних стратегија за превенцију и лечење [1].
Гојазност је сложена, мултифакторска болест, а боље разумевање механизама који леже у основи интеракције између начина живота, животне средине и генетике је кључно за развој ефикасних стратегија за превенцију и лечење [1]. Животињски модели пружају јединствене могућности за високо контролисане студије које пружају механистички увид у улогу специфичних епигенетских ознака, и као индикатора тренутног метаболичког статуса и као предиктора будућег ризика од гојазности и метаболичке болести. Посебно важан аспект студија на животињама је то што омогућавају процену епигенетских промена у циљним ткивима, укључујући јетру и хипоталамус, што је много теже код људи. Штавише, способност сакупљања великих количина свежег ткива омогућава процену вишеструких трагова хроматина, као и метилацију ДНК. Неке од ових епигенетских модификација, било саме или у комбинацији, могу реаговати на програмирање животне средине. На животињским моделима је такође могуће проучавати више генерација потомака и на тај начин омогућити диференцијацију између трансгенерацијског и међугенерацијског преноса ризика од гојазности посредованог епигенетским памћењем родитељског нутритивног статуса, који се не може лако разликовати у студијама на људима. Први термин користимо за мејотски пренос ризика у одсуству континуиране изложености, док други првенствено подразумева директан пренос ризика путем метаболичког репрограмирања фетуса или гамета.
Животињски модели пружају јединствене могућности за високо контролисане студије које пружају механистички увид у улогу специфичних епигенетских ознака, и као индикатора тренутног метаболичког статуса и као предиктора будућег ризика од гојазности и метаболичке болести. Посебно важан аспект студија на животињама је то што омогућавају процену епигенетских промена у циљним ткивима, укључујући јетру и хипоталамус, што је много теже код људи. Штавише, способност сакупљања великих количина свежег ткива омогућава процену вишеструких трагова хроматина, као и метилацију ДНК. Неке од ових епигенетских модификација, било саме или у комбинацији, могу реаговати на програмирање животне средине. На животињским моделима је такође могуће проучавати више генерација потомака и на тај начин омогућити диференцијацију између трансгенерацијског и међугенерацијског преноса ризика од гојазности посредованог епигенетским памћењем родитељског нутритивног статуса, који се не може лако разликовати у студијама на људима. Први термин користимо за мејотски пренос ризика у одсуству континуиране изложености, док други првенствено подразумева директан пренос ризика путем метаболичког репрограмирања фетуса или гамета.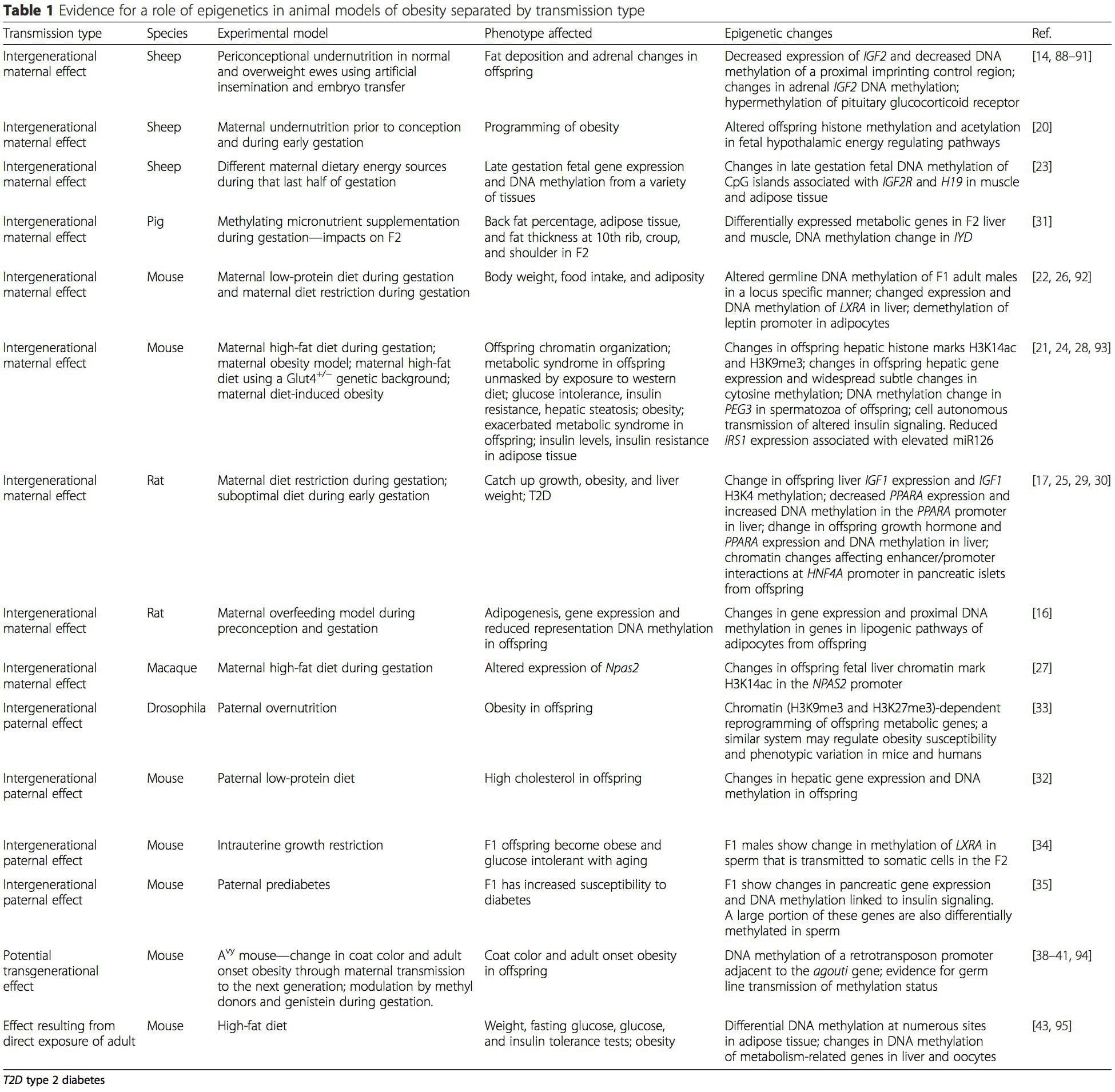 (и) Епигенетске промене у потомству повезане са исхраном мајке током гестације
(и) Епигенетске промене у потомству повезане са исхраном мајке током гестације Додатак исхрани мајке, недовољна исхрана и прекомерна исхрана током трудноће могу променити таложење масти и енергетску хомеостазу код потомства [11, 13, 15, 19]. Повезане са овим ефектима код потомства су промене у метилацији ДНК, посттранслационе модификације хистона и експресија гена за неколико циљних гена, посебно гена који регулишу метаболизам масних киселина и сигнализацију инсулина [16, 17, 20, 30]. Разноликост животињских модела коришћених у овим студијама и заједнички метаболички путеви на које је утицао сугеришу еволутивно очуван адаптивни одговор посредован епигенетском модификацијом. Међутим, неколико специфичних идентификованих гена и епигенетских промена је унакрсно потврђено у сродним студијама, а истраживања на нивоу генома обично нису примењена. Главна препрека упоређивању ових студија су различити развојни ментални прозори који су подвргнути нутриционистичким изазовима, који могу узроковати знатно различите исходе. Потребан је и доказ да су епигенетске промене узрочне, а не повезане са фенотипским променама потомака. Ово ће захтевати идентификацију родитељског нутритивно индукованог епигенетског одговора 'меморије' који претходи развоју измењеног фенотипа код потомства.
Додатак исхрани мајке, недовољна исхрана и прекомерна исхрана током трудноће могу променити таложење масти и енергетску хомеостазу код потомства [11, 13, 15, 19]. Повезане са овим ефектима код потомства су промене у метилацији ДНК, посттранслационе модификације хистона и експресија гена за неколико циљних гена, посебно гена који регулишу метаболизам масних киселина и сигнализацију инсулина [16, 17, 20, 30]. Разноликост животињских модела коришћених у овим студијама и заједнички метаболички путеви на које је утицао сугеришу еволутивно очуван адаптивни одговор посредован епигенетском модификацијом. Међутим, неколико специфичних идентификованих гена и епигенетских промена је унакрсно потврђено у сродним студијама, а истраживања на нивоу генома обично нису примењена. Главна препрека упоређивању ових студија су различити развојни ментални прозори који су подвргнути нутриционистичким изазовима, који могу узроковати знатно различите исходе. Потребан је и доказ да су епигенетске промене узрочне, а не повезане са фенотипским променама потомака. Ово ће захтевати идентификацију родитељског нутритивно индукованог епигенетског одговора 'меморије' који претходи развоју измењеног фенотипа код потомства. Нове студије су показале да очев ниво исхране може утицати на таложење масти и епигенетске ознаке потомака [31, 34]. Једно недавно истраживање на мишевима показало је да очеви пред-дијабетес доводи до повећане осетљивости на дијабетес код Ф1 потомака са повезаним променама у експресији гена панкреаса и метилацији ДНК која је повезана са инсулинском сигнализацијом [35]. Важно је да је дошло до преклапања ових епигенетских промена у острвцима панкреаса и сперми, што указује на наслеђивање заметне линије. Међутим, већина ових студија, иако интригантна у својим импликацијама, ограничена је у геномској скали истраживања и често показује слабе и донекле пролазне епигенетске промене повезане са благим метаболичким фенотиповима код потомака.
Нове студије су показале да очев ниво исхране може утицати на таложење масти и епигенетске ознаке потомака [31, 34]. Једно недавно истраживање на мишевима показало је да очеви пред-дијабетес доводи до повећане осетљивости на дијабетес код Ф1 потомака са повезаним променама у експресији гена панкреаса и метилацији ДНК која је повезана са инсулинском сигнализацијом [35]. Важно је да је дошло до преклапања ових епигенетских промена у острвцима панкреаса и сперми, што указује на наслеђивање заметне линије. Међутим, већина ових студија, иако интригантна у својим импликацијама, ограничена је у геномској скали истраживања и често показује слабе и донекле пролазне епигенетске промене повезане са благим метаболичким фенотиповима код потомака.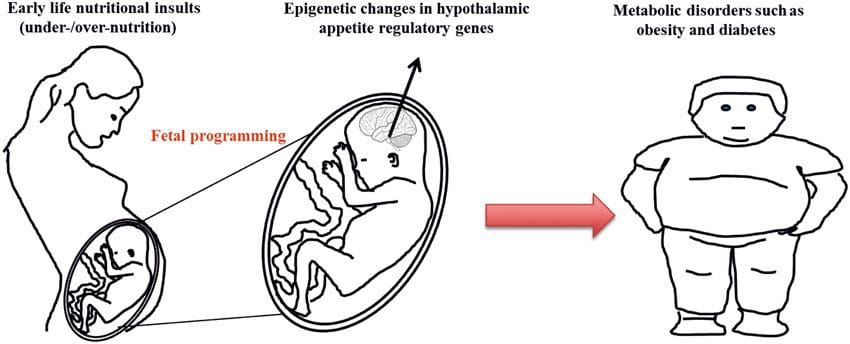 Стабилан пренос епигенетских информација кроз више генерација добро је описан у биљним системима и Ц. елеганс, али се о његовом значају код сисара још увек много расправља [36, 37]. Епигенетска основа за пренос фенотипова од баке и родитеља као одговор на изложеност исхрани је добро утврђена, укључујући и врсте стоке [31]. Најутицајније студије које демонстрирају ефекте епигенетског преноса који утичу на фенотип потомства користиле су пример одрживог жутог агоути (Ави) миша [38]. Код овог миша, уметање ретротранспозона узводно од агоути гена узрокује његову конститутивну експресију и последичну жуту боју длаке и гојазност код одраслих. Пренос мајке преко заметне линије доводи до утишавања експресије агоути посредованог метилацијом ДНК, што резултира бојом длаке дивљег типа и мршавим фенотипом потомства [39, 40]. Важно је да су накнадне студије на овим мишевима показале да излагање мајке донаторима метила изазива промену боје длаке [41]. Једна студија је пријавила пренос фенотипа на генерацију Ф3 и промене у експресији великог броја гена као одговор на рестрикцију протеина у Ф0 [42]; међутим, промене у експресији су биле веома варијабилне и директна веза са епигенетским променама није идентификована у овом систему.
Стабилан пренос епигенетских информација кроз више генерација добро је описан у биљним системима и Ц. елеганс, али се о његовом значају код сисара још увек много расправља [36, 37]. Епигенетска основа за пренос фенотипова од баке и родитеља као одговор на изложеност исхрани је добро утврђена, укључујући и врсте стоке [31]. Најутицајније студије које демонстрирају ефекте епигенетског преноса који утичу на фенотип потомства користиле су пример одрживог жутог агоути (Ави) миша [38]. Код овог миша, уметање ретротранспозона узводно од агоути гена узрокује његову конститутивну експресију и последичну жуту боју длаке и гојазност код одраслих. Пренос мајке преко заметне линије доводи до утишавања експресије агоути посредованог метилацијом ДНК, што резултира бојом длаке дивљег типа и мршавим фенотипом потомства [39, 40]. Важно је да су накнадне студије на овим мишевима показале да излагање мајке донаторима метила изазива промену боје длаке [41]. Једна студија је пријавила пренос фенотипа на генерацију Ф3 и промене у експресији великог броја гена као одговор на рестрикцију протеина у Ф0 [42]; међутим, промене у експресији су биле веома варијабилне и директна веза са епигенетским променама није идентификована у овом систему.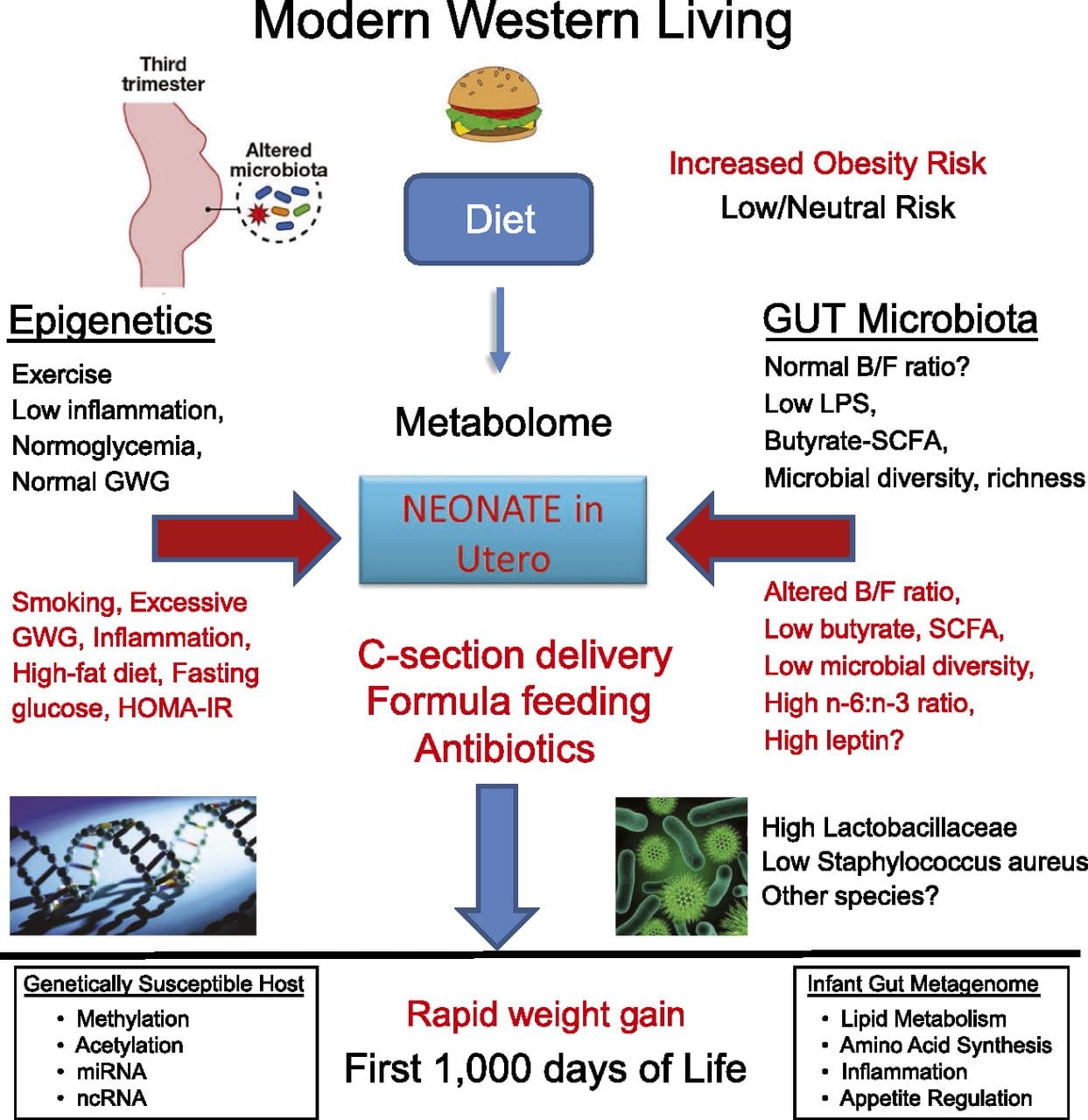 Док су многе студије идентификовале епигенетске промене повезане са исхраном у животињским моделима користећи регионе специфичне за место кандидата, спроведено је неколико анализа у целом геному. Недавна студија се фокусирала на одређивање директног епигенетског утицаја исхране са високим садржајем масти/дијетом изазване гојазности код одраслих мишева коришћењем експресије гена у целом геному и анализе метилације ДНК [43]. Ова студија је идентификовала 232 различито метилована региона (ДМР) у адипоцитима контролних мишева и мишева са високим садржајем масти. Важно је да су одговарајући људски региони за мишје ДМР такође различито метиловани у масном ткиву из популације гојазних и мршавих људи, наглашавајући на тај начин изузетну еволуциону конзервацију ових региона. Овај резултат наглашава вероватну важност идентификованих ДМР-а у регулисању енергетске хомеостазе код сисара.
Док су многе студије идентификовале епигенетске промене повезане са исхраном у животињским моделима користећи регионе специфичне за место кандидата, спроведено је неколико анализа у целом геному. Недавна студија се фокусирала на одређивање директног епигенетског утицаја исхране са високим садржајем масти/дијетом изазване гојазности код одраслих мишева коришћењем експресије гена у целом геному и анализе метилације ДНК [43]. Ова студија је идентификовала 232 различито метилована региона (ДМР) у адипоцитима контролних мишева и мишева са високим садржајем масти. Важно је да су одговарајући људски региони за мишје ДМР такође различито метиловани у масном ткиву из популације гојазних и мршавих људи, наглашавајући на тај начин изузетну еволуциону конзервацију ових региона. Овај резултат наглашава вероватну важност идентификованих ДМР-а у регулисању енергетске хомеостазе код сисара.
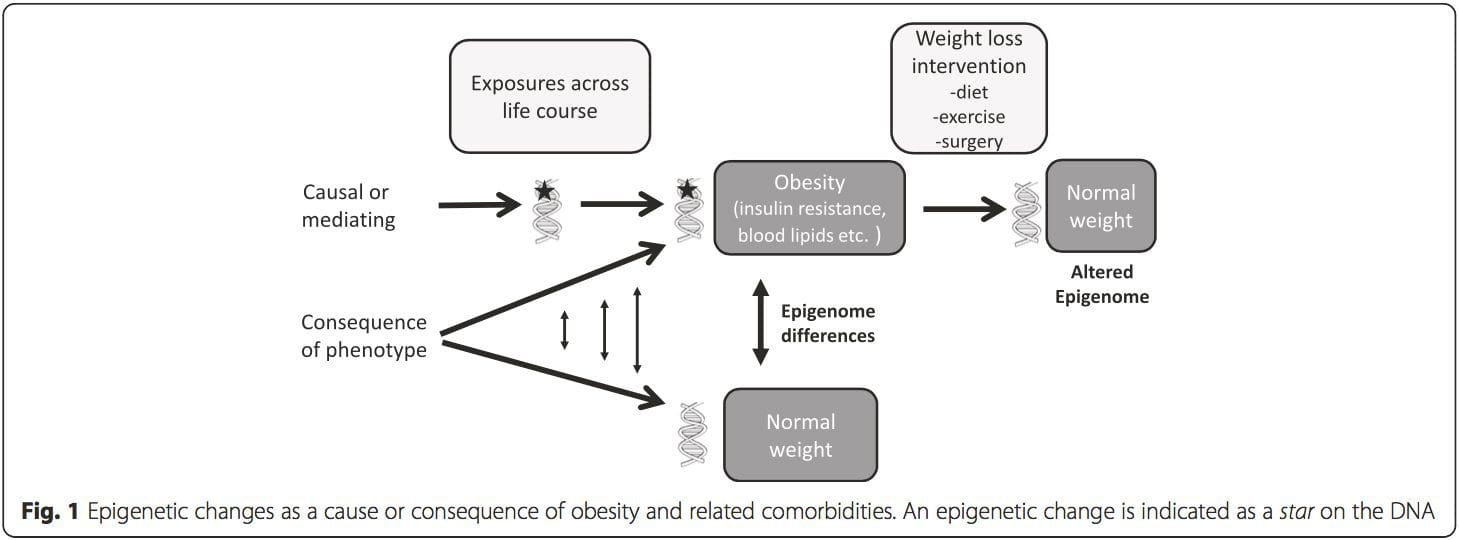 (и) Студије генетске асоцијације. Генетски полиморфизми који су повезани са повећаним ризиком од развоја одређених стања су а приори повезани са узрочним генима. Присуство диференцијалне метилације у таквим регионима указује на функционалну релевантност ових епигенетских промена у контроли експресије проксималног(их) гена(ова). Постоје јаки генетски ефекти који делују на цис који подржавају многе епигенетске варијације [7, 45], а у студијама заснованим на популацији примењене су методе које користе генетске сурогате да би се закључила узрочна или посредничка улога разлика у епигеному [7, 46�48] . Употреба породичних генетичких информација такође може довести до идентификације потенцијално узрочних региона кандидата који показују диференцијалну метилацију везану за фенотип [49].
(и) Студије генетске асоцијације. Генетски полиморфизми који су повезани са повећаним ризиком од развоја одређених стања су а приори повезани са узрочним генима. Присуство диференцијалне метилације у таквим регионима указује на функционалну релевантност ових епигенетских промена у контроли експресије проксималног(их) гена(ова). Постоје јаки генетски ефекти који делују на цис који подржавају многе епигенетске варијације [7, 45], а у студијама заснованим на популацији примењене су методе које користе генетске сурогате да би се закључила узрочна или посредничка улога разлика у епигеному [7, 46�48] . Употреба породичних генетичких информација такође може довести до идентификације потенцијално узрочних региона кандидата који показују диференцијалну метилацију везану за фенотип [49].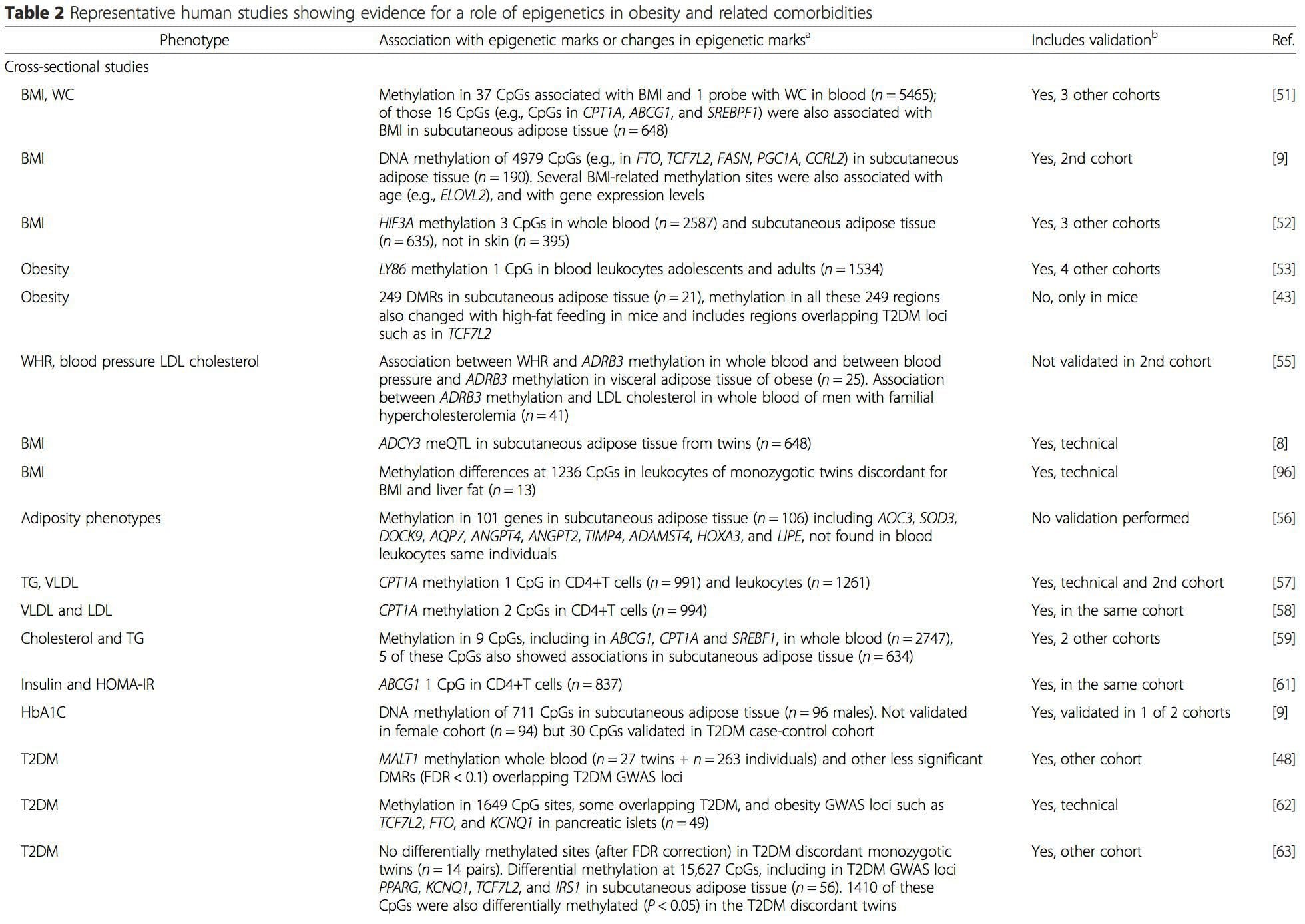
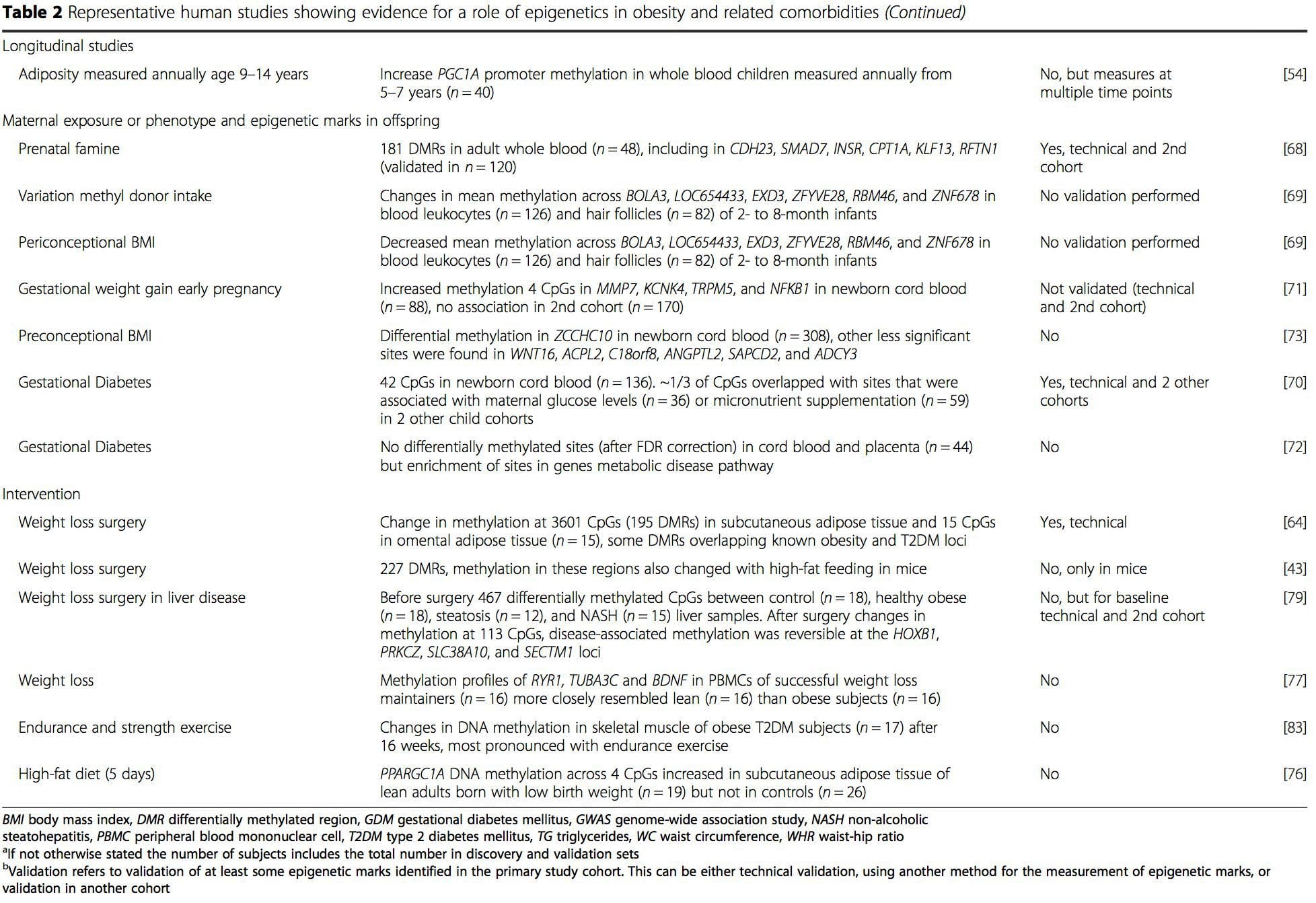 Из ових студија, измењена метилација ПГЦ1А, ХИФ3А, АБЦГ1 и ЦПТ1А и претходно описаног РКСРА [18] појавиле су се као биомаркери повезани са, или можда предвиђајући, метаболичко здравље који су такође могући кандидати за улогу у развоју метаболичке болести. .
Из ових студија, измењена метилација ПГЦ1А, ХИФ3А, АБЦГ1 и ЦПТ1А и претходно описаног РКСРА [18] појавиле су се као биомаркери повезани са, или можда предвиђајући, метаболичко здравље који су такође могући кандидати за улогу у развоју метаболичке болести. . Епигенетска варијација је под великим утицајем основне генетске варијације, при чему се процењује да генотип објашњава ~20% варијације [40, 6]. Недавно су бројне студије почеле да интегришу податке о метилому и генотипу да би се идентификовали локуси квантитативних особина метилације (меКТЛ) повезани са фенотиповима болести. На пример, у масном ткиву, меКТЛ који се преклапа са локусом генетског ризика БМИ идентификован је у елементу појачивача узводно од АДЦИ8 [3]. Друге студије су такође идентификовале преклапања између познатих локуса ризика од гојазности и Т8ДМ и ДМР-а повезаних са гојазношћу и Т2ДМ [2, 43, 48]. Метилација једног броја таквих ДМР-а је такође модулисана храњењем са високим садржајем масти код мишева [62] и губитком тежине код људи [43]. Ови резултати идентификују интригантну везу између генетских варијација повезаних са осетљивошћу на болести и њихове повезаности са регионима генома који су подвргнути епигенетским модификацијама као одговор на нутритивне изазове, што имплицира узрочну везу. Блиска веза између генетске и епигенетске варијације може означити њихову суштинску улогу у стварању индивидуалних варијација [64, 65]. Међутим, док ови налази сугеришу да метилација ДНК може бити посредник генетских ефеката, такође је важно узети у обзир да и генетски и епигенетски процеси могу деловати независно на исте гене. Студије близанаца [66, 8, 63] могу пружити важне увиде и указати на то да међуиндивидуалне разлике у нивоима метилације ДНК проистичу претежно из неподељеног окружења и стохастичких утицаја, минимално из заједничких ефеката животне средине, али и са значајним утицајем генетских варијација.
Епигенетска варијација је под великим утицајем основне генетске варијације, при чему се процењује да генотип објашњава ~20% варијације [40, 6]. Недавно су бројне студије почеле да интегришу податке о метилому и генотипу да би се идентификовали локуси квантитативних особина метилације (меКТЛ) повезани са фенотиповима болести. На пример, у масном ткиву, меКТЛ који се преклапа са локусом генетског ризика БМИ идентификован је у елементу појачивача узводно од АДЦИ8 [3]. Друге студије су такође идентификовале преклапања између познатих локуса ризика од гојазности и Т8ДМ и ДМР-а повезаних са гојазношћу и Т2ДМ [2, 43, 48]. Метилација једног броја таквих ДМР-а је такође модулисана храњењем са високим садржајем масти код мишева [62] и губитком тежине код људи [43]. Ови резултати идентификују интригантну везу између генетских варијација повезаних са осетљивошћу на болести и њихове повезаности са регионима генома који су подвргнути епигенетским модификацијама као одговор на нутритивне изазове, што имплицира узрочну везу. Блиска веза између генетске и епигенетске варијације може означити њихову суштинску улогу у стварању индивидуалних варијација [64, 65]. Међутим, док ови налази сугеришу да метилација ДНК може бити посредник генетских ефеката, такође је важно узети у обзир да и генетски и епигенетски процеси могу деловати независно на исте гене. Студије близанаца [66, 8, 63] могу пружити важне увиде и указати на то да међуиндивидуалне разлике у нивоима метилације ДНК проистичу претежно из неподељеног окружења и стохастичких утицаја, минимално из заједничких ефеката животне средине, али и са значајним утицајем генетских варијација. Пренатално окружење: Две недавно објављене студије су користиле људске популације које су искусиле „природне” варијације у снабдевању хранљивим материјама за проучавање утицаја исхране мајке пре или током трудноће на метилацију ДНК у потомству [68, 69]. Прва студија је користила гамбијску кохорту мајка-дете да покаже да су и сезонске варијације у уносу метил донора током трудноће и БМИ мајке пре трудноће повезане са измењеном метилацијом код новорођенчади [69]. Друга студија је користила одрасле потомке из кохорте Холандске зиме глади да би истражила ефекат пренаталне изложености акутном периоду тешке потхрањености мајке на метилацију ДНК гена укључених у раст и метаболизам у одраслом добу [68]. Резултати су нагласили важност времена изложености у њеном утицају на епигеном, пошто су значајни епигенетски ефекти идентификовани само код особа које су биле изложене глади током ране гестације. Важно је да су се епигенетске промене десиле у спрези са повећаним БМИ; међутим, у овој студији није било могуће утврдити да ли су ове промене биле присутне раније у животу или су последица вишег БМИ.
Пренатално окружење: Две недавно објављене студије су користиле људске популације које су искусиле „природне” варијације у снабдевању хранљивим материјама за проучавање утицаја исхране мајке пре или током трудноће на метилацију ДНК у потомству [68, 69]. Прва студија је користила гамбијску кохорту мајка-дете да покаже да су и сезонске варијације у уносу метил донора током трудноће и БМИ мајке пре трудноће повезане са измењеном метилацијом код новорођенчади [69]. Друга студија је користила одрасле потомке из кохорте Холандске зиме глади да би истражила ефекат пренаталне изложености акутном периоду тешке потхрањености мајке на метилацију ДНК гена укључених у раст и метаболизам у одраслом добу [68]. Резултати су нагласили важност времена изложености у њеном утицају на епигеном, пошто су значајни епигенетски ефекти идентификовани само код особа које су биле изложене глади током ране гестације. Важно је да су се епигенетске промене десиле у спрези са повећаним БМИ; међутим, у овој студији није било могуће утврдити да ли су ове промене биле присутне раније у животу или су последица вишег БМИ. Постнатално окружење: Епигеном се успоставља де ново током ембрионалног развоја, па стога пренатално окружење највероватније има најзначајнији утицај на епигеном. Међутим, сада је јасно да се промене дешавају у „зрелом“ епигеному под утицајем низа услова, укључујући старење, излагање токсинима и промене у исхрани. На пример, промене у метилацији ДНК у бројним генима у скелетним мишићима и ПГЦ1А у масном ткиву су демонстриране као одговор на исхрану са високим садржајем масти [75, 76]. Интервенције за губитак телесне масне масе такође су повезане са променама у метилацији ДНК. Студије су известиле да профили метилације ДНК масног ткива [43, 64], мононуклеарних ћелија периферне крви [77] и мишићног ткива [78] код претходно гојазних пацијената постају сличнији профилима мршавих субјеката након губитка тежине. Операција губитка тежине је такође делимично поништила промене метилације повезане са безалкохолном масном јетром у јетри [79], а у другој студији довела је до хипометилације више гена кандидата за гојазност, са израженијим ефектима у поткожном у односу на оменталну (висцералну) масноћу [64] . Акумулирани докази сугеришу да интервенције вежбањем такође могу утицати на метилацију ДНК. Већина ових студија спроведена је на мршавим особама [80], али једна студија вежбања код гојазних субјеката са Т82ДМ такође је показала промене у метилацији ДНК, укључујући и гене укључене у транспорт масних киселина и глукозе [2]. Епигенетске промене се такође јављају са старењем, а новији подаци указују на улогу гојазности у њиховом повећању [83, 9, 84]. Гојазност је убрзала епигенетску старост ткива јетре, али за разлику од горе описаних налаза, овај ефекат није био реверзибилан након губитка тежине [85].
Постнатално окружење: Епигеном се успоставља де ново током ембрионалног развоја, па стога пренатално окружење највероватније има најзначајнији утицај на епигеном. Међутим, сада је јасно да се промене дешавају у „зрелом“ епигеному под утицајем низа услова, укључујући старење, излагање токсинима и промене у исхрани. На пример, промене у метилацији ДНК у бројним генима у скелетним мишићима и ПГЦ1А у масном ткиву су демонстриране као одговор на исхрану са високим садржајем масти [75, 76]. Интервенције за губитак телесне масне масе такође су повезане са променама у метилацији ДНК. Студије су известиле да профили метилације ДНК масног ткива [43, 64], мононуклеарних ћелија периферне крви [77] и мишићног ткива [78] код претходно гојазних пацијената постају сличнији профилима мршавих субјеката након губитка тежине. Операција губитка тежине је такође делимично поништила промене метилације повезане са безалкохолном масном јетром у јетри [79], а у другој студији довела је до хипометилације више гена кандидата за гојазност, са израженијим ефектима у поткожном у односу на оменталну (висцералну) масноћу [64] . Акумулирани докази сугеришу да интервенције вежбањем такође могу утицати на метилацију ДНК. Већина ових студија спроведена је на мршавим особама [80], али једна студија вежбања код гојазних субјеката са Т82ДМ такође је показала промене у метилацији ДНК, укључујући и гене укључене у транспорт масних киселина и глукозе [2]. Епигенетске промене се такође јављају са старењем, а новији подаци указују на улогу гојазности у њиховом повећању [83, 9, 84]. Гојазност је убрзала епигенетску старост ткива јетре, али за разлику од горе описаних налаза, овај ефекат није био реверзибилан након губитка тежине [85].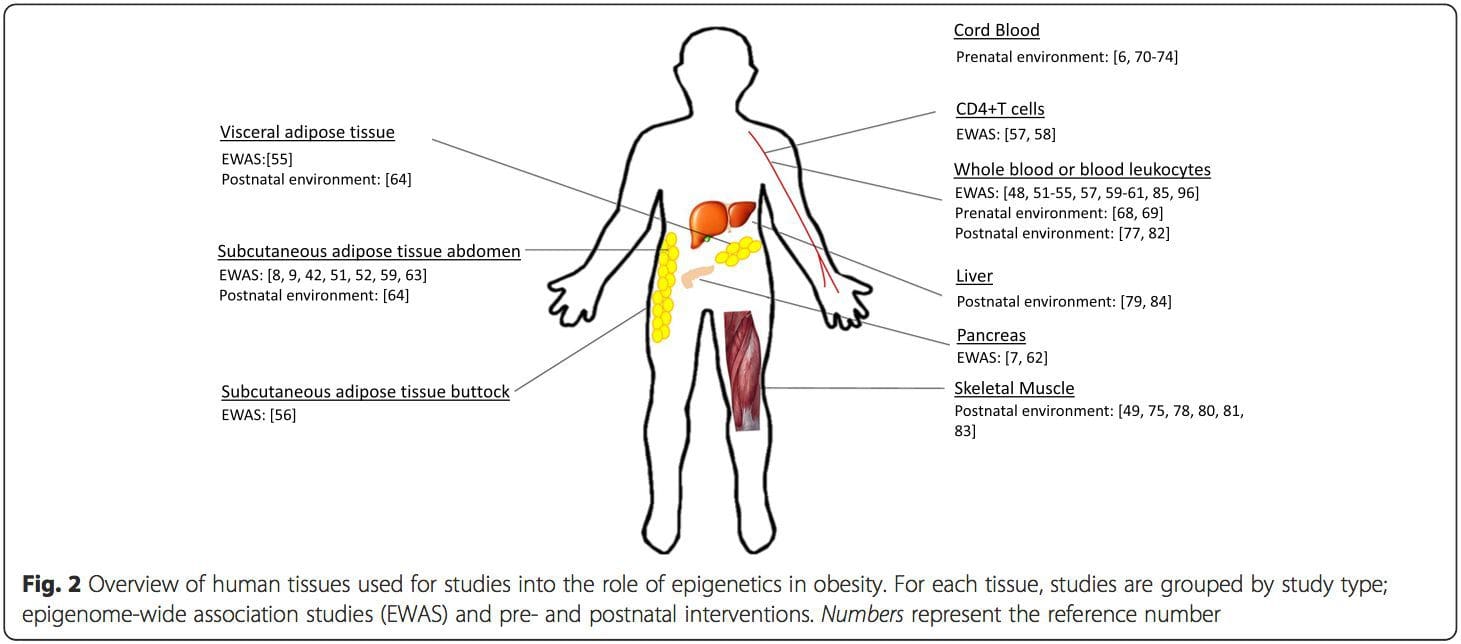 Закључци
Закључци



