Неуроинфламација:
Апстрактан
Вишеструки докази подржавају патогену улогу неуроинфламе у психијатријским болестима. Иако су системске аутоимуне болести добро документовани узроци неуропсихијатријских поремећаја, синаптички аутоимуни енцефалитиди са психотичним симптомима често су недовољно препознати. Паралелно са везом између психијатријских симптома и аутоимуности код аутоимуних болести, неуроимунолошке абнормалности се јављају код класичних психијатријских поремећаја (на пример, велики депресивни, биполарни, шизофренија и опсесивно-компулзивни поремећаји). Истраживања патофизиологије ових стања традиционално су наглашавала поремећај регулације глутаматергичног и моноаминергичног система, али механизми који узрокују ове абнормалности неуротрансмитера и даље су неухватљиви. Прегледали смо везу између аутоимуности и неуропсихијатријских поремећаја, као и људске и експерименталне доказе који подржавају патогену улогу неуроинфламе у одабраним класичним психијатријским поремећајима. Разумевање интеракције психосоцијалних, генетских, имунолошких и неуротрансмитерских система може открити патогене трагове и помоћи у циљању нових превентивних и симптоматских терапија.
Кључне речи:
- Неуроинфламматион,
- Психонеуроимунологија,
- Астроцит,
- Мицроглиа,
- Цитокини,
- Оксидативни стрес,
- Депресија,
- Опсесивно компулзивни поремећај,
- Биполарни поремећај, шизофренија
Садржај
увод
Како се биолошке абнормалности све више идентификују међу пацијентима са психијатријским поремећајима, разлика између неуролошких и психијатријских болести бледи. Поред системских аутоимуних болести повезаних са психијатријским манифестацијама (на пример, лупус) [1], недавно су пацијенти са акутном изолованом психозом идентификовани са синаптичким аутоимуним енцефалитидима (Табела 1) [2-6]. Овим пацијентима се често погрешно дијагностикује ватросталним примарним психичким поремећајима, што одлаже започињање ефикасне имунолошке терапије (Табела 1). Поред тога, све већи број доказа подржава патогену улогу анти-неуронских антитела у неуропсихијатријским поремећајима [7].
Раздвајање неуролошких и психијатријских поремећаја, подржано Декартовом концепцијом 'ума' као онтолошки различитог ентитета и репродуцибилношћу неуропатолошких абнормалности, доминирало је медицином у...19. и почетком 20. века [8]. Од тада је све већа збирка поновљивих биолошких узрока, од неуросифилиса, трауме главе, можданог удара, тумора, демијелинизације и многих других, проузроковала комплексе симптома који су се преклапали са класичним психијатријским поремећајима [9-11]. У новије време забележене су неуроинфламаторне и имунолошке абнормалности код пацијената са класичним психијатријским поремећајима.
Периферни имуни модулатори могу изазвати психијатријске симптоме код животињских модела и људи [12-19]. Здраве животиње којима је убризган проинфламаторни ИЛ-1? и цитокини фактора некрозе тумора алфа (ТНФ-?) показују 'понашање болести' повезано са социјалним повлачењем [12]. Код људи, ињекције ниске дозе ендотоксина деактивирају вентрални стријатум, регион који је критичан за процесирање награђивања, производећи анхедонију као исцрпљујући депресивни симптом [14]. Приближно 45% пацијената са хепатитисом Ц и канцером без депресије лечених ИФН-? развити депресивне симптоме повезане са повећаним нивоом ИЛ-6 у серуму [12,15,17,18].
Медицинска стања повезана са хроничним инфламаторним и имунолошким абнормалностима, укључујући гојазност, дијабетес, малигне болести, реуматоидни артритис и мултиплу склерозу, су фактори ризика за депресију и биполарни поремећај [10,12,13,15,17,18]. Позитивно�корелација између ових медицинских стања и психијатријске болести сугерише присуство широко распрострањеног основног запаљеног процеса који погађа мозак међу осталим органима [10,19,20]. Тридесетогодишње истраживање засновано на популацији показало је да имају аутоимуну болест или претходна хоспитализација због озбиљне инфекције повећала је ризик од развоја шизофреније за 29%, односно 60% [16]. Даље, вирус херпес симплекса, Токопласма гондии, цитомегаловирус и грип током трудноће повећавају ризик од развоја шизофреније [16].
Периферни ћелијски [21,22] (табела 2) и хуморалне имунолошке абнормалности [13,21-23] су чешћи код психијатријских пацијената у односу на здраву контролу. У оба пилота (н = 34 пацијента са великим депресивним поремећајем (МДД), н = 43 здраве контроле) и студијама репликације (н = 36 МДД, н = 43 здраве контроле), серумски тест који је обухватио девет серумских биомаркера разликовао је испитанике са МДД од здравих контроле са 91.7% осетљивости и 81.3% специфичности; значајно повишени биомаркери за неуропсихијатријске симптоме били су имунолошки молекули алфа 1 антитрипсин, мијелопероксидаза и растворљиви ТНФ-? рецептор ИИ [23].
 Прво разматрамо везу између аутоимуности и неуропсихијатријских поремећаја, укључујући: 1) системски еритемски лупус (СЛЕ) као прототип системске аутоимуне болести; 2) аутоимуни енцефалитиди повезани са серумским антисинаптичким и глукотамином киселином декарбоксилазом (ГАД) аутоантителима; и 3) дечји неуропсихијатријски аутоимуни поремећаји повезани са стрептококним инфекцијама (ПАНДАС) и чисти опсесивно-компулзивни поремећај (ОЦД) повезани са анти-базалним ганглијима / таламичким ауто-антителима. Затим разговарамо о улози урођене упале / аутоимуности у класичним психијатријским поремећајима, укључујући МДД, биполарни поремећај (БПД), шизофренију и ОЦД.
Прво разматрамо везу између аутоимуности и неуропсихијатријских поремећаја, укључујући: 1) системски еритемски лупус (СЛЕ) као прототип системске аутоимуне болести; 2) аутоимуни енцефалитиди повезани са серумским антисинаптичким и глукотамином киселином декарбоксилазом (ГАД) аутоантителима; и 3) дечји неуропсихијатријски аутоимуни поремећаји повезани са стрептококним инфекцијама (ПАНДАС) и чисти опсесивно-компулзивни поремећај (ОЦД) повезани са анти-базалним ганглијима / таламичким ауто-антителима. Затим разговарамо о улози урођене упале / аутоимуности у класичним психијатријским поремећајима, укључујући МДД, биполарни поремећај (БПД), шизофренију и ОЦД.
Неуропсихијатријски поремећаји повезани са аутоимунитетом
Системски еритематозни лупус
Између 25% до 75% пацијената са СЛЕ има захваћеност централног нервног система (ЦНС), са психијатријским симптомима који се обично јављају у прве две године од почетка болести. Психијатријски симптоми могу укључивати анксиозност, расположење и психотичне сметње [97]. Магнетна резонанца мозга (МРИ) је нормална у приближно 42% неуропсихијатријских случајева СЛЕ [97]. Микроангиопатија и распад крвно-мождане баријере (БББ) могу дозволити улазак аутоантитела у мозак [97]. Ова антитела укључују анти-рибозомални П (позитиван код 90% психотичних пацијената са СЛЕ) [1], анти-ендотелне ћелије, анти-ганглиозиде, анти-дсДНК, анти-2А/2Б подјединице Н-метил-Д-аспартатних рецептора ( НМДАР) и анти-фосфолипидна антитела [97]. Проинфламаторни цитокини – пре свега ИЛ-6 [97], С100Б�[97], интраћелијски адхезиони молекул 1 [97] и матрикс-металопротеиназа-9 [98] су такође повишени код СЛЕ. Психијатријске манифестације СЛЕ, Сјогренове болести, Сусацовог синдрома, ЦНС васкулитиса, ЦНС Вхиппле-ове болести и Бехцет-ове болести су недавно прегледане [1].
Неуропсихијатријски аутоимуни енцефалитиди повезани са антисинаптичком и глутаминском киселином у серуму декарбоксилазом
Аутоантитела
Аутоимуне енцефалитиде карактеришу акутни напади темпоралног режња, психијатријске карактеристике и когнитивни дефицити [2,3,99-108]. Патофизиологијом се обично посредују аутоантитела која циљају синаптичке или унутарћелијске аутоантигене у сарадњи са паранео пластиком или непаранеопластичним пореклом [3]. Антисинаптична аутоантитела циљају НР1 подјединице НМДАР [100,108,109], напонски вођене калијумове канале (ВГКЦ) комплексе (Кв1 подјединица, инактивиран глиомом богат леуцином (ЛГИ1) и протеин повезан са контактима 2 (ЦАСПР2)) [101,102,106], ГлуР1 и ГлуР2 подјединице амино-3- хидрокси-5-метил-л-4-изоксазолпропионске киселине рецептора (АМПАР) [6,110,111] и Б1 подјединице рецептора а-аминобутирне киселине Б (ГАБАБР) [3,99,103]. Анти-унутарћелијска аутоантитела циљају онконеуронал и ГАД-65 аутоантигене [2,3].
Запаљење повезано са антисинаптичним аутоантителима, посебно НМДАР-аутоантителима, обично је много блаже од упале повезано са ГАД-аутоантителима или анти-неуронским аутоантителима у вези са системским аутоимунским поремећајима или паранеопластичним синдромима [2,107].
Иако се на крају појављују неуролошки симптоми, психијатријске манифестације, у распону од анксиозности [2,3] до психозе која опонаша шизофренију [2-6], у почетку могу да доминирају или претходе неуролошким особинама. До две трећине пацијената са анти-НМДАР аутоимуним енцефалитисом, иницијално присутним у психијатријским службама [5]. Ауто-имуни енцефалитиди посредовани антисинаптичним антителима морају се узети у обзир у диференцијали акутне психозе [2-6]. Психијатријске презентације могу да укључују нормалну магнетну резонанцу мозга и цереброспиналну течност (ЦСФ), без енцефалопатије или напада [2,3,5,6,107]. Извештавали смо о случају серопозитивних ГАД аутоантитела повезаних са биопсијом доказаном неуроинфламатом, упркос нормалним анализама магнетне резонанце и цереброспиналне мождине, где је пацијент имао дијагнозу изоловане психозе као шизофренија према Дијагностичком и статистичком приручнику за менталне поремећаје, 4. издање (ДСМ-ИВ) [2]. Даље, серонегативни аутоимуни енцефалитиди могу се такође појавити са израженим неуропсихијатријским поремећајима, чинећи дијагнозу неухватљивијом [107,112,113]. Психијатријске и неуролошке особине повезане са антисанаптичким и ГАД аутоантителима су сумиране у Табели 1 [1-6,99-108,114].
Анти-синаптичка и ГАД аутоантитела у серуму могу се појавити код пацијената са чистим психијатријским поремећајима [2,4,5,112,115-121]. У проспективној кохорти од 29 испитаника који су задовољили ДСМ-ИВ критеријуме за шизофренију, серумска анти-НМДАР ауто антитела пронађена су код три субјекта, а анти-ВГКЦ комплекс антитела код једног субјекта [5]. Коришћењем осетљивијих техника за откривање ауто-антитела на имуноглобулин Г (ИгГ) НР1 код 100 пацијената са дефинитивном шизофренијом, нису идентификована аутоантитела [122]. Међутим, ова студија није проценила аутоантитела која циљају НР2 подјединицу НМДАР. Друге студије су известиле о знатно повећаном изгледу за повишене (? 90. перцентил нивои непсихијатријске контроле) нивоа НР2 антитела (однос шанси (ОР) 2.78, 95% интервал поверења (ЦИ) 1.26 до 6.14, П = 0.012) међу особама са акутном манијом ( н = 43), али не и код хроничне маније или шизофреније [116].
ПАНДАС и чисти опсесивно-компулзивни поремећај повезан са анти-базалним ганглијама / таламичким аутоантителима
ОКП често компликује неуролошке поремећаје који укључују базалне ганглије, укључујући Сиденхамову хореју, Хантингтонову болест и Паркинсонову болест. Антитела против базалних ганглија су укључена у Сиденхамову хореју [123]. ПАНДАС се карактерише акутним погоршањем симптома ОКП и/или моторичким/фоничким тиковима након продромалне ?-хемолитичке стрептококне инфекције групе А. Сматра се да патофизиологија укључује унакрсну реактивност између анти-стрептококних антитела и протеина базалних ганглија [124]. Клиничко преклапање између ПАНДАС-а и чистог ОКП сугерише заједнички етиолошки механизам [125].
Међу насумичном кохортом од 21 чистог ОЦД пацијента, 91.3% је имало ЦСФ анти-базалне ганглије (П <0.05) и антиталамичка аутоантитела (П <0.005) на 43 кДа [88], паралелне функционалне абнормалности у кортико-стриатном-таламом -кортикална кола испитаника ОЦД [84]. Друга студија је документовала да је 42% (н = 21) ОЦД педијатријских и адолесцената имало серумска аутоантитела против базалних ганглија на 40, 45 и 60 кДа у поређењу са 2% до 10% контрола (П = 0.001) [7]. Аутоантитела против базалних ганглија откривена су у серуму 64% испитаника ПАНДАС (н = 14), у поређењу са само 9% (н = 2) стрептококално позитивних/ОЦД негативних контрола (П <0.001) [126]. Једна студија није пронашла разлику између преваленције аутоантитела против базалних ганглија у ОКП (5.4%, н = 4) у односу на контролу МДД (0%) [127]; међутим, ограничење је било насумично коришћење кортекса пацова и базалних ганглија и кортекса говеда које је могло ограничити идентификацију серопозитивних случајева.
Аутоантигени базалних ганглија су алдолаза Ц (40 кДа), неуронско специфична/неуронска енолаза (дублет од 45 кДа) и пируват киназа М1 (60 кДа) -неуронски гликолитички ензими - укључени у неуротрансмисију, неуронски метаболизам
Страна 3 од 24 и ћелијска сигнализација [128]. Ови ензими показују значајну структурну хомологију са стрептококним протеинима [129]. Најновија студија (96 ОЦД, 33 МДД, 17 испитаника са шизофренијом) тестирала је серум пацијената против пируват киназе, алдолазе Ц и енолазе, посебно; већи проценат ОЦД субјеката је био серопозитиван у односу на контролну групу (19.8% (н = 19) наспрам 4% [н = 2], П = 0.012) [130].
Ипак, у истој студији само један од 19 серо-позитивних испитаника са ОЦД такође је имао позитивне нивое антитела на стрептолизин О, што сугерише да у чистом ОЦД серонегативност антитела на стрептолизин О не искључује присуство ауто-антитела против базалних ганглија .
У чистом ОЦД, серопозитивност на антбазална ганглија / таламична антитела повезана је са повишеним нивоима ЦСФ глицина (П = 0.03) [88], што сугерише да ова антитела доприносе хиперглутаматергији примећеној код ОЦД [84,88,131]. Побољшање ОЦД изазваног инфекцијом имунолошким терапијама подржава патогеност ових аутоантитела [132]. У току је велико испитивање НИХ којим се процењује ефикасност интравенског имуноглобулина (ИВИГ) за децу са акутним ОЦД и антитересптококним антителима (ЦлиницалТриалс.гов: НЦТ01281969). Међутим, налаз незнатно већих нивоа глутамата у ликвору код пацијената са ОЦД са негативним антителима против базалних ганглија / таламуса у ликвору у поређењу са онима са позитивним антителима на ликвор, сугерише да неимунолошки механизми могу играти улогу у настанку ОЦД [84]. Претпостављени су и други механизми, укључујући упале посредоване цитокинима (Табела 2).
Психијатријски поремећаји повезани са урођеном упалом
Поремећаји урођене инфламације/аутоимуности јављају се код неких пацијената са класичним психијатријским поремећајима. Разговарамо о урођеним абнормалностима ЦНС-а повезаних са инфламацијом, укључујући глијалну патологију, повишене нивое цитокина, активацију циклооксигеназе, дисрегулацију глутамата, повећане нивое С100Б, повећан оксидативни стрес и БББ дисфункцију код МДД, БПД, шизофреније и ОЦД. Такође описујемо како урођена упала може бити механички повезана са традиционалним моноаминергичким и глутаматергијским абнормалностима пријављеним у овим поремећајима (Слике 1 и 2). Такође се разматра терапијска улога антиинфламаторних средстава код психијатријских поремећаја.
 Астроглиал & Олигодендроглиал Хистопатхологи
Астроглиал & Олигодендроглиал Хистопатхологи
Астроглиа и олигодендроглиа су од суштинског значаја за неуралне метаболичке хомеостаза, понашање и више когнитивне функције [54-56,133-136]. Нормална мирна астроглија обезбеђује енергетску и трофичку подршку неуронима, регулише синаптичку неуротрансмисију (Слика 2), синаптогенезу, церебрални проток крви и одржава интегритет БББ [134,136,137]. Зрела олигодендроглија обезбеђује енергетску и трофичку подршку неуронима и одржава интегритет БББ и регулише поправку аксона�и мијелинизација тракта беле материје који пружају интер- и интра-хемисферну повезаност [54-56]. И астроглија и олигодендроглија производе антиинфламаторне цитокине који могу да регулишу штетно упалу [52,55].
Код МДД-а, астроглијски губитак је доследни пост-мортем налаз у функционално релевантним областима, укључујући предњи цингулативни кортекс, префронтални кортекс, амигдалу и белу материју [35-38,42-46,55,138-147], са неколико изузетака [42,43 , 37,38]. Пост-мортем студије откриле су смањену глијалну фибриларну киселину (ГФАП) позитивну астроглијску густину првенствено у префронталном кортексу [36] и амигдали [39]. Велика протеомска анализа фронталних кортекса код депресивних пацијената показала је значајно смањење три ГФАП изоформе [75]. Иако је у једној студији која није пријавила значајнији глијални губитак, анализа подгрупа открила је значајно смањење (45%) ГФАП-позитивне астроглијске густине међу испитаницима млађим од 35 година [148]. Морфометријска студија на сличан начин није показала промене глија густине у мозгу МДД-а касног живота [35]. Претпостављамо да очигледно одсуство астроглијског губитка код старијих пацијената са МДД може одражавати секундарну астроглиозу [42,50] која је повезана са старијим узрастом [XNUMX], а не истински негативан.
Студије на животињама су у складу са студијама на људима које показују губитак астроглиа у МДД. Вистар-Киото пацови за које је познато да показују депресивно понашање открили су смањену астроглијалну густину у истим областима као што је примећено код људи [40]. Примена астроглијално токсичног агенса, Л-алфа-аминоадипинске киселине, индукује симптоме сличне депресији код пацова, што сугерише да је губитак астроглије патоген у МДД [41].
Пост-мортем студије на МДД-овима документовале су смањену олигодендроглиалну густину у префронталном кортексу и амигдали [54-57,66], што може бити у корелацији са жаришним променама у белој материји МРИ мозга које се повремено примећују код неких пацијената са МДД-ом [57]. Међутим, микроваскуларне абнормалности такође могу допринети овим променама [57].
У БПД-у, неке студије показују значајан глијални губитак [138,143,149,150], док друге не [37,44-46]. Ова недоследна открића могу произићи из недостатка контроле за: 1) лечење стабилизаторима расположења, јер је пост-хоц анализа, коју су известиле неке студије, показала значајно смањење глијалног губитка тек након контроле лечења литијумом и валпроичном киселином [46]; 2) породични облици БПД-а, јер је глијални губитак посебно изражен међу пацијентима са БПД-ом са јаком породичном историјом [143]; и / или, 3) преовлађујуће стање депресије у односу на манију, јер је глијални губитак чест код МДД [35-38,42-46,55,138-147]. Нејасно је да ли астроглија или олигодендроглија чине највећи део глијалног губитка; док је протеомска анализа открила значајан пад у једној астроглијалној ГФАП изоформи [39], неколико других пост-мортем студија открило је или непромењену [36,37] или смањену ГФАП-позитивну астроглијску експресију у орбитрофронталној кори [47], или смањену густину олигодендроглије [ 54-56,58,59].
Код шизофреније, астроглијски губитак је недоследан налаз [48,150]. Иако неке студије нису показале значајнији астроглијски губитак [42,50,51], неколико других је пронашло смањену астроглијску густину [37,38,43,44,48,49,151] и значајно смањење у две ГФАП изоформе [39]. Неусклађени налази могу произаћи из: 1) МДД коморбидитета, који је често повезан са глијалним губитком; 2) старосне варијације, јер су старији пацијенти повећали ГФАП-позитивну астроглију [35,42,50]; 3) варијабилност регионалног [150] и кортикалног слоја [48]; 4) лечење антипсихотичним лековима, јер експерименталне студије показују и смањену [152] и повећану [153] астроглијску густину у вези са хроничним антипсихотичким лечењем [70]; и 5) стање болести (на пример, самоубилачко и несуицидално понашање) [154]. Пост-мортем студије су документовале губитак олигодендроглије [54,56,60-65,148,155,156], посебно у префронталном кортексу, предњем цингуларном кортексу и хипокампусу [148]. Ултраструктурни преглед префронталне регије показао је абнормално мијелинизована влакна и у сивој и у белој материји; и старост и трајање болести били су у позитивној корелацији са абнормалностима беле материје [157].
За разлику од неуродегенеративних поремећаја који су уобичајено повезани са астроглиалном пролиферацијом [136], психички поремећаји су уместо тога повезани или са смањеном или непромењеном астроглијалном густином [138]. Недостатак повећане глијалне густине у раним психијатријским поремећајима [44,138] може одразити на спорију стопу дегенеративне прогресије код психијатријских болести [138].
Ми претпостављамо да су дегенеративне промене повезане са психијатријским поремећајима суптилније и недовољно озбиљне да изазову астроглијске интрацелуларне факторе транскрипције који позитивно регулишу астроглиозу, укључујући активатор претварача сигнала транскрипције 3 и нуклеарни фактор капа Б (НФ-? Б) [136].
Док се већина пост-мортем студија фокусирала на промену глија густине код МДД, БПД и шизофреније, други су описали промену морфологије глија ћелија са мешовитим налазима. Код МДД и БПД, величина глија је или повећана или непромењена [55]. Једна студија је открила смањену величину глија код БПД-а и шизофреније, али не и код МДД-а [43]. Пост мортем студија депресивних пацијената који су извршили самоубиство открила је повећану астроглијску величину у предњој цингулатској белој материји, али не и у кортексу [158]. Једна студија на шизофреним испитаницима открила је значајно смањену астроглијску величину у слоју В дорзолатералног префронталног кортекса, упркос томе што је астроглијска густина двоструко већа од контроле у истом слоју [48]. Мешовити резултати могу делимично одражавати раније студије глијалних промена на психијатријским болестима које нису прецизирале астроглију наспрам олигодендроглије [148].
Губитак глија код психијатријских болести може допринети неуроинфламацији кроз неколико механизама, укључујући абнормалне нивое цитокина (видети одељак о цитокини), нерегулисани метаболизам глутамата (видети одељак о глутамату), повишен протеин С100Б (видети одељак С100Б),�и измењена функција БББ (видети одељак Крвно-мождана баријера), што је резултирало оштећеним сазнањем и понашањем [44,45,54,133,159].
Микроглијска хистопатологија
Мицроглиа су резидентне имуне ћелије ЦНС-а. Они пружају континуирани имунолошки надзор и регулишу развој синаптичког обрезивања [160,161]. Повреда ЦНС трансформише разгранату мировању у мировању у активиране издужене штапичасте и макрофаге сличне фагоцитне амебоидне ћелије које се размножавају и мигрирају ка месту повреде дуж хемотаксичких градијената (то јест, микроглијална активација и пролиферација (МАП)) [161]. Људске микроглијске ћелије изражавају НМДАР-ове који могу посредовати МАП што доводи до повреде неурона [162].
Код МДД, БПД и шизофреније, резултати пост-мортем студија које истражују присуство МАП су мешани. Пост-мортем студије откриле су повишен МАП само код једног од пет испитаника са МДД-ом [67]. Код неких пацијената са БПД поремећајем, повећана леукоцитна антиген-ДР-позитивна микроглија која показује задебљале процесе забележена је у фронталном кортексу [69]. У шизофренији, док су неке студије известиле о повишеном МАП у односу на контроле, друге нису показале разлику између група [22,67,70]. У пост мортем студији која процењује МАП код МДД и БПД; густина микроглијалних ћелија позитивне кинолинске киселине повећана је у субгенуалном предњем кортексу цингулата и предњем срцу можданог кортекса код пацијената са МДД и БПД који су извршили самоубиство у односу на контролу [53]. Пост-хоц анализа открила је да се овај повећани МАП могао приписати искључиво МДД-у, а не БПД-у, јер је позитивно микроглијално имуно-бојење код испитаника са МДД-ом било значајно веће од оног у БПД-подгрупи и у субгенуалном предњем цингулату и у мидцингулатном кортексу, а густина микроглије је била слична и у БПД и у контролним групама [53]. Студија која упоређује сва три поремећаја (девет МДД, пет БПД, четрнаест шизофреније, десет здравих контрола) није показала значајну разлику у густини микроглија у све четири групе [68].
Ови мешовити резултати могу се приписати променљивим микроглијским имунолошким маркерима који се користе у различитим студијама [70] и / или неуспеху контроле тежине болести [22,53,68]. Значајно је да су три пост мортем студије МДД-а и шизофрених испитаника документовале снажну позитивну корелацију између МАП-а и самоубиства у кортексу предњег цингулата и медиодорсалног таламуса, независно од психијатријске дијагнозе [22,53,68]. Дакле, МАП може бити држава, а не маркер особина за МДД и шизофренију.
У ОЦД, животињски модели сугеришу да дисфункција и смањење одређених микроглијских фенотипова, попут оних који изражавају Хокб8 ген, који кодира фактор транскрипције хомеобокса, могу проузроковати понашање слично ОЦД [71,72].
Мишеви са нокаутом Хокб8 показују претерано понашање у нези и анксиозност у вези са смањеном густином микроглија [71,72]. Ово претерано понашање неге подсећа на карактеристике понашања људског ОЦД-а. Ињекција Хокб8 код одраслих нокаут мишева Хокб8 преокреће губитак микроглија и враћа нормално понашање [71,72]. Улога ових специфичних микроглијских фенотипова у ОЦД код људи није јасна.
Експериментални подаци сугеришу да МАП садржи препознатљиве штетне и неуропротективне фенотипове (слика 2). Штетне микроглије не изражавају главни комплекс хистокомпатибилности ИИ (МХЦ-ИИ) и, према томе, не могу деловати као ћелије које представљају антиген (АПЦ) [163,164]; промовишу штетне ефекте [17,69,165] кроз проинфламаторну производњу цитокина, сигнализацију азот-оксид-синтазе [17,166], промовишући експресију глија и БББ-перицита / ендотела циклооксигеназе-2 (ЦОКС-2) [167], индукујући астроглијску секрецију С100Б (види С100Б одељак) и микроглијално ослобађање глутамата [17,136,168,169]. Штетна микроглија такође лучи простагландин Е-2 (ПГЕ-2) који промовише производњу проинфламаторних цитокина, што заузврат повећава ниво ПГЕ-2 у повратном циклусу [29]. Даље, ПГЕ-2 стимулише експресију ЦОКС-2, која посредује у конверзији арахидонске киселине у ПГЕ-2, успостављајући још један повратни циклус [29].
Насупрот томе, неуропротективна микроглија може: 1) да изрази МХЦ-ИИ ин виво и ин витро [163,166] и делује као сродни АПЦ (слика 2) [163,164,166]; 2) олакшати зарастање и ограничити оштећење неурона промовишући лучење противупалних цитокина [17], неуротрофичног фактора изведеног из мозга [17] и фактора раста сличног инсулину [1]; и 166) експресују ексцитациони транспортер аминокиселина-3 (ЕААТ2) који елиминише вишак ванћелијског глутамата [2] и промовише неуропротективну Т лимфоцитну аутоимуност (слика 163,166) [2]. Међутим, потребно је више студија како би се потврдила доприносна улога неуропротективне микроглије неуропсихијатријским поремећајима код људи.
Ин витро студије на животињама сугеришу да на однос штетне и неуропротективне микроглије може утицати нето ефекат запаљенских контрарегулаторних механизама [15,74,164,166]. Ови механизми укључују број неуропротективних ЦД4 + ЦД25 + ФОКСП3 + Т регулаторних ћелија ((Т регс) Слика 1) [15,74,164,166] и ниво мозга цитокина; низак ИФН-? нивои могу промовисати неуропротективну микроглију (слика 2) [166], док високи нивои могу промовисати штетни фенотип [166].
Улога цитокина
Проинфламаторни цитокини укључују ИЛ-1а, ИЛ-2, ИЛ-6, ТНФ-? и ИФН-?. Луче их првенствено микроглија, Тх1 лимфоцити и М1 фенотип моноцити/макрофаги (Слика 1) [15,170]. Они промовишу штетну упалу. Антиинфламаторни цитокини укључују ИЛ-4, ИЛ-5 и ИЛ-10. Њих првенствено лучи астроглиа,�Тх2 лимфоцити, Т регс и М2 фенотип моноцити / макрофаги [15,52,74]. Они могу ограничити штетно запаљење [15,74] претварањем проупалног М1-фенотипа у благотворни протуупални М2-фенотип [15], а потенцијално и промовисањем неуропротективног микроглијског фенотипа [15,17,74,163,166]. Улога проинфламаторних / антиинфламаторних цитокина у психијатријским поремећајима поткрепљена је са неколико линија доказа (слика 1, табела 2) [15,17,29,52,74].
У МДД, најновија метаанализа (29 студија, 822 МДД, 726 здравих контрола) серумских проупалних цитокина потврдила је да су растворљиви ИЛ-2 рецептор, ИЛ-6 и ТНФ-? нивои су повећани код МДД (маркера особина) [91], док се ИЛ-1а, ИЛ-2, ИЛ-4, ИЛ-8 и ИЛ-10 статистички не разликују од контрола [91]. У примарној студији цитокина упоређујући подгрупе МДД (47 самоубилачких МДД, 17 несуицидних МДД, 16 здравствених контрола), оба серума ИЛ-6 и ТНФ-? били знатно већи, док су нивои ИЛ-2 били знатно нижи код испитаника са МДД-ом који су извршили самоубиство у односу на обе друге групе [96]. Ово откриће сугерише да ИЛ-6 и ТНФ-? су такође државни маркери МДД [96]. Смањење нивоа ИЛ-2 у серуму повезано са акутним самоубилачким понашањем може одражавати повећано везивање за његов регулирани рецептор у мозгу; паралелно са поменутом мета-анализом која показује повећани растворљиви ИЛ-2 рецептор у МДД [91]. Студије које су истраживале клинички значај цитокина у МДД-у показале су да су нивои цитокина у серуму повишени током акутних депресивних епизода [171,172] и нормализовани након успешног, али не и неуспешног лечења антидепресивима [17] и електро-конвулзивне терапије [29]; ови налази указују на могућу патогену улогу цитокина.
У БПД, промене серумског цитокина су сумиране у недавном прегледу; ТНФ-а, ИЛ-6 и ИЛ-8 су повишени током маничне и депресивне фазе, док су ИЛ-2, ИЛ-4 и ИЛ-6 повишени током маније [92]. Друга испитивања су показала да се серум ИЛ-1? и нивои ИЛ-1 рецептора се статистички не разликују од здравих контрола [92], иако су студије ткива документовале повећани ниво ИЛ-1? и ИЛ-1 рецептор у БПД фронталном кортексу [69].
Код шизофреније, резултати студија које истражују абнормалности цитокина су опречни (Табела 2). Док су неке студије откриле и смањене проинфламаторне цитокине у серуму (ИЛ-2, ИФН-?) и повећане антиинфламаторне цитокине у серуму и ЦСФ (ИЛ-10) [52], друге су откриле повишене серумске про- и антиинфламаторне цитокине, са доминацијом проинфламаторног типа [22,173,174]. ]. Једна мета-анализа цитокина (62 студије, 2,298 шизофренија, 858 здравих контрола) показала је повећане нивое антагониста ИЛ-1Р, сИЛ-2Р и ИЛ-6 [174]. Међутим, ова студија није узела у обзир употребу антипсихотика, за које се сматра да појачавају производњу проинфламаторних цитокина [52]. Новија мета-анализа цитокина (40 студија, 2,572 шизофреничара,4,401 контрола) који су чинили антипсихотике, открили су да су ТНФ-а, ИФН-а, ИЛ-12 и сИЛ-2Р константно повишени у хроничној шизофренији независно од активности болести (обележивачи особина), док ИЛ-1а, ИЛ-6 и трансформишући фактор раста бета позитивно корелира са активношћу болести (државни маркери) [173]. Ћелијске културе мононуклеарних ћелија периферне крви (ПБМЦ) добијене од шизофрених пацијената произвеле су виши ниво ИЛ-8 и ИЛ-1? спонтано, као и након стимулације ЛПС-ом, што сугерише улогу активираних моноцита / макрофага у патологији шизофреније [175].
У ОЦД, резултати насумичног испитивања цитокина у серуму и ликвору и ПБМЦ-стимулисаних ЛПС студија су недоследни [93-95,176-179]. Постоји корелација између ОЦД и функционалног полиморфизма у промоторском региону ТНФ-а? ген [34], мада студије са малом снагом нису потврдиле ову повезаност [180]. Стога мешовити резултати студија које документују или повишени или смањени ТНФ-? нивои цитокина [93,176-178] могу одражавати њихово променљиво укључивање подскупина ОЦД субјеката са овим одређеним полиморфизмом у њиховим кохортама.
Поларизација одговора цитокина у главној депресији и шизофренији
Фенотипови одговора на цитокине су класификовани или као проинфламаторни Тх1 (ИЛ-2, ИФН-?) или као антиинфламаторни Тх2 (ИЛ-4, ИЛ-5, ИЛ-10) према имунолошким функцијама које регулишу. Док Тх1 цитокини регулишу ћелијски посредовани имунитет усмерен против интраћелијских антигена, Тх2 цитокини регулишу хуморални имунитет усмерен против екстраћелијских антигена [29,52]. Тх1 цитокине производе Тх1 лимфоцити и М1 моноцити, док Тх2 цитокине производе Тх2 лимфоцити и М2 моноцити [29,52]. У мозгу, микроглија претежно лучи Тх1 цитокине, док астроглија претежно лучи Тх2 цитокине [29,52]. Реципрочни однос Тх1:Тх2 цитокина, од сада 'Тх1-Тх2 клацкалица,' је под утицајем пропорције активиране микроглије (вишак Тх1) и астроглије (вишак Тх2) и интеракције између активираних Т ћелија и прекомерних нивоа глутамата у ЦНС-у за које смо претпоставили да фаворизује Тх1 одговор (слика 2) [29,163,166].
Неравнотежа клацкалица Тх1-Тх2 може утицати на метаболизам триптофана променом његових ензима [21,52], премештајући тако катаболизам триптофана према кинуренину (КИН) и катаболизам КИН према било којем од своја два низводна метаболита; микроглија кинолинска киселина која је посредована Тх1 одговором или астроглијска кинуренска киселина (КИНА) (слика 1) која је посредована Тх2 одговором [21,29,170].
Ензими метаболизма триптофана на које утиче Тх1-Тх2 клацкалица укључују (Слика 1): индолеамин 2,3-диоксигеназу (ИДО) изражену микрогијом и астрогијом, ензимима који ограничавају брзину који посредују у конверзији триптофана у КИН и серотонина у 5- хидроксииндолсирћетна киселина�[21,29]. Кинуренин 3-монооксигеназа (КМО), искључиво експримирана микрогијом, је ензим који ограничава брзину који претвара КИН у 3-хидроксикинуренин (3-ОХ-КИН), који се даље метаболише у хинолинску киселину [21,29]. Триптофан-2,3-диоксигеназа (ТДО), изражена искључиво помоћу астроглије, је ензим који ограничава брзину претварања�триптофан у КИН [21,29]. Кинуренине аминотрансфераза (КАТ), изражена првенствено у астроглијским процесима, је ензим који ограничава брзину и посредује у конверзији КИН у КИНА [21,29].
Тх1 цитокини активирају микроглијални ИДО и КМО, померајући микроглијални КИН катаболизам ка кинолинском.киселине (НМДАР агонист), док Тх2 цитокини активирају микроглијски ИДО и КМО, померајући астроглијски КИН катаболизам ка ТДО и КАТ посредованој КИНА (НМДАР антагонист) синтези (слика 1) [21,29].
Тх1 и Тх2 доминантни имунофенотипови су предложени за МДД и шизофренију, респективно, на основу периферних, а не ЦНС, образаца цитокина [52,173]. Верујемо да су обрасци периферних цитокина непоуздани сурогат маркери оних у ЦНС-у. Заиста, на нивое периферних цитокина могу утицати многе ван-ЦНС варијабле, које нису доследно контролисане у неколико студија периферних цитокина, укључујући: 1) старост, индекс телесне масе, психотропне лекове, пушење, стрес и циркадијалне флуктуације; 2) утицај�активност / стање болести на стварању синтезе одабраних цитокина [95,173]; и 3) ефекте психотропних средстава на производњу цитокина [52]. Кратки полуживоти и брзи промет серумских цитокина [181] (на пример, 18 минута за ТНФ-а [182] наспрам 60 минута за ИЛ-10 [183]) могу додатно ограничити поузданост тумачења њихових нивои мерени из случајног узорковања серума.
Код МДД, постоји консензус да проинфламаторни Тх1 имунофенотипски одговор преовлађује (Табела 2) [17,29]. Високи нивои кинолинске киселине у постморталном МДД мозгу [53] сугеришу присуство појачаног Тх1 одговора (Слика 1) [21,29]. Повишена кинолинска киселина ЦНС-а може подстаћи апоптозу хумане астроглије посредовану приливом калцијума [184], што хипотетички може да отупи.Тх2 одговор изведен из астроглије [29], превртање Тх1 наспрам Тх2 клацкалица у корист микроглија Тх1 одговора. Хипозеротонергија ЦНС [29] додаје додатну подршку прекомерном Тх1 одговору, који показује да смањује синтезу ЦНС серотонина [185] и повећава његову разградњу (слика 1) [21,29].
Хиперглутаматергија ЦНС-а такође може допринети прекомерном Тх1 одговору у мозгу (слика 2). Студија ин витро сугерише да периферни Т-лимфоцити у мировању конститутивно изражавају метаботропни глутаматни рецептор 5 (мГлуР5) [164], чије везивање за глутамат инхибира ослобађање лимфоцитног ИЛ-6, чиме смањује регулацију ауто-реактивне пролиферације Т-ефекторских ћелија [164]. Активирани Т-лимфоцити, али не и Т-лимфоцити који мирују, могу прећи БББ [37].
Експериментални подаци сугеришу да интеракција између Т ћелијских рецептора активираних Т лимфоцита и њихових сродних ћелија које представљају антиген може да смањи регулацију мГлуР5 и индукује експресију мГлуР1 [164]. На животињским моделима, везивање вишка глутамата за лимфоцитне мГлуР1 рецепторе промовише производњу Тх1 цитокина, укључујући ИФН-? [164].
Претпостављамо да код неких пацијената са МДД, паралелно са експерименталним подацима [164], везивање вишка глутамината ЦНС-а за индуковане лимфоцитне мГлуР1 рецепторе може допринети прекомерном Тх1 одговору, укључујући ИФН-? (Слика 2). Спекулишемо да је ИФН-? у малој количини, слично својим ин витро ефектима на микроглију [166], може да индукује микроглијалну експресију МХЦ-ИИ и ЕААТ2 [163,166], омогућавајући микроглији да служи као сродне ћелије које представљају антиген и да обезбеди функцију поновног узимања глутамата [163,164,166], чиме се штетна микроглија трансформише у неуропротективни фенотип [163,166] који учествује у уклањању вишка ванћелијског глутамата [163,164,166]. Према томе, такође претпостављамо да је вишак Тх1 одговора у подгрупама пацијената са МДД мач са две оштрице, који промовише штетно запаљење и служи као благотворни контра-регулаторни механизам који може ограничити вишак неуроексцитотоксичности повезане са глутаматом (слика 2).
Код шизофреније, док неке студије периферних цитокина сугеришу превласт антиинфламаторног Тх2 имунофенотипа/одговора [52], друге то побијају [173,174]. Међутим, слажемо се са ауторима који су претпоставили да је Тх2 одговор доминантан фенотип код шизофреније [52]. Повишени нивои КИНА у мозгу, ликвору и серуму [21,52] указују на смањење микро-глијалног ИДО и КМО, што је функција Тх2 одговора који помера астроглијални КИН катаболизам ка синтези КИНА (Слика 1) [21,52]. Смањена КМО активност и експресија КМО мРНА у постмортем шизофреничним мозговима [73] је у складу са вишком Тх2 одговора (Слика 1). Повећана преваленција абнормалности хуморалног имунитета посредованих Тх2 у подгрупама пацијената са шизофренијом – о чему сведочи повећан број Б ћелија [21,76], повећан�производња аутоантитела укључујући антивирусна антитела [76] и повећани имуноглобулин Е [52] – додаје даљу подршку хипотези о доминацији Тх2 одговора.
Неуроинфламматион & ДНС-регулација глутамата у ЦНС-у
Глутамат посредује у сазнању и понашању [186]. Нивоаптични глутамат регулишу глијални и неуронски ЕААТ зависни од натријума, наиме КСАГ-систем одговоран за поновно преузимање глутамата / ослобађање аспартата [137,164] и астроглијски глутамат / цистински антипортер независни од натријума (Ксц-) одговоран за ослобађање глутамата / поновни унос цистина [164]. Астроглиални ЕААТ1 и ЕААТ2 пружају више од 90% поновног узимања глутамата [79].
Неуроинфламација може изменити метаболизам глутамата и функцију његових транспортера [15,29,187,188], производећи когнитивна, бихевиорална и психијатријска оштећења [15,21,29,79,186,188,189]. Абнормалности функције / експресије ЕААТ и метаболизма глутамата у МДД, БПД, шизофренији и ОЦД су резимирани у Табели 2.
У МДД постоје докази за кортикалну хиперглутаматергију (Табела 2). Кортикални ниво глутамата корелирао је позитивно са тежином симптома депресије, а петонедељни курс антидепресива смањио је концентрацију глутамата у серуму [85,86]. Једна доза кетамина, снажног НМДАР антагониста, може недељу дана да преокрене ватростални МДД [17,21,29,85]. Прекомерни нивои глутамата у ЦНС-у могу да изазову упале посредоване неуротоксичношћу [163,164,188], укључујући проинфламаторни Тх1 одговор (слика 2) [164].
Ограничени ин витро докази сугеришу да упала / проинфламаторни цитокини могу повећати ниво глутамата у ЦНС-у [188] у повратном циклусу кроз неколико потенцијалних механизама: 1) проинфламаторни цитокини могу инхибирати [15,17,168] и обрнути [45,137] астроглијски глутамат посредован ЕААТ-ом функција поновног преузимања; 2) проинфламаторни цитокини могу побољшати синтезу микроглијалне хинолинске киселине [53], што је експериментално показано да поспешује ослобађање синаптосомалног глутамата [15,17,29,190]; 3) повећани ЦОКС-2 / ПГЕ-2 и ТНФ-? нивои могу да индукују прилив калцијума [137], што на основу ин витро података може повећати ослобађање астроглијског глутамата и Д-серина [191]; и 4) активирана микроглија може да изрази вишак Ксц-антипортерских система који посредују у ослобађању глутамата [164,192].
Код шизофреније, пронађена је префронтална кортикална хипоглутаматергија [87,90,193,194] (Табела 2) и смањена функционалност НМДАР-а [5]. Недавна мета-анализа спектроскопије Х1 магнетне резонанце (МРС) (28 студија, 647 шизофренија, 608 контрола) потврдила је смањење глутамата и повећање нивоа глутамина у медијалном фронталном кортексу [90]. Улога упале која доприноси хипоглутаматергији није доказана. Повишена синтеза КИНА у мозгу шизофреније [21,52], типично функција Тх2 одговора (Слика 1), може инхибирати НР1 подјединицу НМДАР и алфа 7 никотинске.ацетилхолински рецептор (? 7нАцхР) [195], што доводи до смањене функције НМДАР и смањеног ослобађања глутамата посредованог? 7нАцхР [195].
Подаци о БПД-у и ОЦД-у указују на кортикалну хипер-глутаматергију ЦНС-а код оба поремећаја (Табела 2) [78,84,88,131]. Допринос упале (БПД и ОЦД) и аутоантитела (ОЦД) [7,77,84,88,130] повећаном нивоу ЦНС глутамата захтева даље испитивање.
Улога С100Б
С100Б је протеин који веже калцијум од 10 кДа, а производе га епидимне ћелије астроглије, олигодендроглије и хороидног плексуса [196]. Посредује своје ефекте на околне неуроне и глију путем рецептора за напредни крајњи производ гликације [196]. Наномоларни изванстанични нивои С100Б пружају благотворне неуротрофичне ефекте, ограничавају неуронске повреде повезане са стресом, инхибирају микроглијски ТНФ-? ослобађање и повећавање поновног узимања астроглијског глутамата [196]. Концентрације Мицромолар С100Б, претежно произведене од активиране астроглије и лимфоцита [196,197, 2], имају штетне ефекте претворене у рецептор за напредни гликациони крајњи производ, који укључују неуронску апоптозу, производњу ЦОКС-2 / ПГЕ-1, ИЛ-21,196,198? и индуцибилне врсте азотног оксида и регулацију моноцитних / микроглијских ТНФ-а? секрета [XNUMX].
Нивои серума, а нарочито ЦСФ и можданог ткива С100Б су показатељи глијалне (претежно астроглијске) активације [199]. У МДД и психози, нивои С100Б у серуму позитивно корелирају са тежином самоубиства, независно од психијатријске дијагнозе [200]. Пост мортем анализа С100Б показала је смањене нивое у дорзолатералном префронталном кортексу МДД и БПД, а повећане нивое у паријеталном кортексу БПД [196].
Мета-анализа (193 поремећаја расположења, 132 здраве контроле) потврдила је повишени ниво серума и ЦСФ С100Б у поремећајима расположења, посебно током акутних депресивних епизода и маније [201].
Код шизофреније, нивои С100Б у мозгу, ликвору и серуму су повишени [199,202]. Мета-анализа (12 студија, 380 шизофренија, 358 здравих контрола) потврдила је повишене нивое С100Б у серуму код шизофреније [203]. У постморталном мозгу испитаника са шизофренијом, С100Б-имунореактивна астроглија се налази у областима које су укључене у шизофренију, укључујући предњи цингулат кортекс, дорсолатерални префронтални кортекс, орбитофронтални кортекс и хипокампус [154]. Повишени нивои С100Б корелирају са параноидном [154] и негативистичком психозом [204], оштећеном когницијом, лошим терапијским одговором и трајањем болести [202]. Генетски полиморфизми у С100Б [32] и рецептору за напредне гене крајњег производа гликације у кохортама шизофреније (Табела 2) [32,33,205] сугеришу да су ове абнормалности вероватно примарне/патогене, а не секундарне/биомаркери. Заиста, смањење нивоа С100Б у серуму након третмана антидепресивима [201] и антипсихотицима [196] сугерише…неки клинички значај С100Б за патофизиологију психијатријских поремећаја.
Неуроинфламација и повећани оксидативни стрес
Оксидативни стрес је стање у којем вишак оксиданата оштећује или модификује биолошке макромолекуле као што су липиди, протеини и ДНК [206-209]. Овај вишак је резултат повећане производње оксиданата, смањеног уклањања оксиданса, оштећене антиоксидативне одбране или неке њихове комбинације [206-209]. Мозак је посебно осетљив на оксидативни стрес због: 1) повишених количина полинезасићених масних киселина које могу да се пероксидирају; 2) релативно висок садржај минерала у траговима који индукују пероксидацију липида и радикале кисеоника (на пример, гвожђе, бакар); 3) велика искоришћеност кисеоника; и 3) ограничени механизми антиоксидације [206,207].
Прекомерни оксидативни стрес може се јавити код МДД [206], БПД [206,207], шизофреније [207,209] и ОЦД [206,208]. Периферни маркери оксидативних поремећаја укључују повећане производе пероксидације липида (на пример, малондиалдехид и 4-хидрокси-2-ноненал), повећане метаболите азотног оксида (НО), смањене антиоксиданте (на пример, глутатион) и измењене нивое ензима антиоксиданата [206,207].
Код МДД-а, повећана производња супероксидног радикалног аниона корелира са повећаном апоптозом неутрофилних медија посредованих оксидацијом [206]. Нивои антиоксидативних ензима у серуму (на пример, супероксид дисмутаза-1) су повишени током акутних депресивних епизода и нормализују се након третмана селективним инхибиторима поновног узимања серотонина (ССРИ) [206]. То сугерише да су код МДД нивои серумских антиоксидативних ензима државни показатељ, који може одражавати компензациони механизам који се супротставља акутном повећању оксидативног стреса. [206]. За разлику од шизофреније, растворљиви растворни ниво супероксид дисмутазе-1 у ликвору је значајно смањен код пацијената са шизофренијом са раним почетком у поређењу са хроничним болесницима са шизофренијом и здравим контролама. Ово сугерише да смањени нивои ензима антиоксиданса у мозгу могу допринети оксидативном оштећењу код акутне шизофреније [210], мада су потребне веће студије да би се потврдио овај налаз.
Неколико додатних експерименталних и људских испитивања детаљније је испитало механизме у основи патофизиологије повећаног оксидативног стреса у психијатријским поремећајима [206-262]. У животињским моделима депресије, ниво глутатиона у мозгу је смањен, док су нивои пероксидације липида и НО повећани [206,262].
Постморталне студије показују смањене нивое укупног глутатиона у мозгу код МДД, БПД [206] и шизофрених испитаника [206,207]. Фибробласти култивисани од пацијената са МДД показују повишен оксидативни стрес независно од нивоа глутатиона [262], аргументујући против примарне улоге смањења глутатиона као главног механизма оксидативног стреса у депресији.
Активација микроглијом може повећати оксидативни стрес кроз производњу проинфламаторних цитокина и НО [206-209]. Проинфламаторни цитокини и високи нивои НО могу да промовишу стварање реактивних врста кисеоника (РОС), што заузврат убрзава пероксидацију липида, оштећујући мембранске фосфолипиде и њихове мембрански везане моноаминске неуротрансмитерске рецепторе и исцрпљујући ендогене антиоксиданте. Повећани РОС производи могу појачати активацију микроглија и повећати проинфламаторну производњу стимулисањем НФ-аБ [208], што заузврат продужава оксидативне повреде [208], стварајући потенцијал за патолошку петљу позитивних повратних информација код неких психијатријских поремећаја [206-209]. Иако неуроинфламација може повећати ниво глутамата у мозгу [85,86], улога глутаматергичне хиперактивности као узрока оксидативног стреса остаје неутемељена [207].
Дисфункција митохондрија може допринети повећаном оксидативном стресу код МДД, БПД и шизофреније [206]. Постморталне студије ових поремећаја откривају абнормалности у митохондријској ДНК, у складу са великом преваленцијом психијатријских поремећаја у примарним митохондријским поремећајима [206]. Студије ин витро на животињама показују да проинфламаторни цитокини, као што је ТНФ-а, могу смањити густину митохондрија и нарушити оксидативни метаболизам митохондрија [211,212], што доводи до повећане производње РОС [206,213]. Ови експериментални налази могу подразумевати механицистичке везе између неуроинфламе, митохондријалне дисфункције и оксидативног стреса [206,213], заслужујући даље истраживање ових укрштајућих патогених путева код људских психијатријских поремећаја.
Рањивост нервног ткива на оксидативно оштећење варира међу различитим психијатријским поремећајима на основу неуроанатомских, неурохемијских и молекуларних путева који су укључени у специфични поремећај [207]. Ефекти лечења такође могу бити критични, јер прелиминарни докази сугеришу да антипсихотици, ССРИ и стабилизатори расположења поседују антиоксидативна својства [206,207,262]. Терапијска улога помоћних антиоксиданата (на пример, витамини Ц и Е) у психијатријским поремећајима остаје да се поткрепи снажним рандомизираним клиничким испитивањима. Н-ацетилцистеин показује најперспективније резултате до данас, са неколико рандомизираних плацебо контролисаних испитивања која показују његову ефикасност код МДД, БПД и шизофреније [207].
Дисфункција крвно-мождане баријере
БББ обезбеђује имунолошки привилеговани статус мозга ограничавањем уласка периферних инфламаторних медијатора, укључујући цитокине и антитела која могу да ометају неуротрансмисију [214,215]. Хипотеза о распаду БББ-а и његовој улози код неких психијатријских пацијената [60,214,216,217] је у складу са повећаном преваленцом психијатријског коморбидитета код болести повезаних са његовом дисфункцијом, укључујући СЛЕ [97], мождани удар [11],�епилепсија [218] и аутоимуни енцефалитиди (табела 1). Повишен „однос ЦСФ: албумин у серуму“ код пацијената са МДД и шизофренијом указује на повећану пропустљивост БББ [214].
У једној студији (63 психијатријска испитаника, 4,100 контрола), абнормалности ЦСФ индикативне за БББ-оштећење откривене су код 41% психијатријских субјеката (14 МДД и БПД, 14 шизофренија), укључујући интратекалну синтезу ИгГ, ИгМ и / или ИгА блага плеоцитоза у ликвору (5 до 8 ћелија по мм3) и присуство до четири ИгГ олигоклоналне траке [216]. Једна пост-мортем ултраструктурна студија о шизофренији открила је БББ ултраструктурне абнормалности у префронталном и визуелном кортексу, што је укључивало вакуоларну дегенерацију ендотелних ћелија, астроглијалне процесе стопала и задебљање и неправилност базалне ламине [60]. Међутим, у овој студији аутори нису коментарисали потенцијални допринос постморталних промена њиховим налазима. Друга студија која истражује транскриптомику БББ ендотелних ћелија у шизофреном мозгу идентификовала је значајне разлике међу генима који утичу на имунолошку функцију, а које нису откривене у контролама [217].
Ендотелна дисфункција посредована оксидацијом може допринети патофизиологији БББ дисфункције у психијатријским поремећајима. Индиректни докази из клиничких и експерименталних студија о депресији [219] и, у мањој мери, о шизофренији [220] сугеришу да повећана оксидација може допринети ендотелној дисфункцији. Ендотелна дисфункција може представљати заједнички механизам који објашњава познату везу између депресије и кардиоваскуларних болести [219,221], што може бити повезано са смањеним нивоом вазодилататора НО [221-223]. Експерименталне студије сугеришу да су смањени нивои ендотелног НО механички повезани са одвајањем ендотелијске синтетазе азот-оксида (еНОС) од њеног есенцијалног ко-фактора тетрахидробиоптерина (БХ4), премештајући њен супстрат из Л-аргинина у кисеоник [224-226]. Неповезани еНОС промовише синтезу РОС (на пример, супероксид) и реактивне азотне врсте (РНС) (на пример, пероксинитрит; производ интеракције супероксида са НО) [227], а не НО, што доводи до оксидационе дисфункције ендотела [ 224-226].
Подаци на животињама показали су да ССРИ могу да обнове недостатне нивое НО у ендотелу [219], што указује на то да антиоксидативни механизми могу допринети њиховим антидепресивним ефектима. Код људи, Л-метилфолат може да појача антидепресивне ефекте ССРИ-а [228], претпоставља се повећањем нивоа БХ4, који је суштински кофактор за еНОС анти-оксидацију посредовану поновним спајањем [229], као и за брзину -граничавајуће ензиме синтезе моноамина (то јест, серотонина, норепинефрина, допамина) [228].
Узети заједно, и недавни рад који наглашава улогу неповезаног еНОС-индукованог оксидативног стреса у патогенези васкуларних болести [230,231] и �епидемиолошке студије које успостављају депресију као независни фактор ризика за васкуларне патологије, попут можданог удара и срчаних болести [219,221], додају додатну подршку клиничкој важности несавезаног еНОС-овог оксидативног оштећења ендотела код депресије. Упркос обилним доказима о абнормалностима цитокина у људским психијатријским болестима и експерименталним подацима који показују да проинфламаторни цитокини могу смањити експресију еНОС [212] и повећати пропусност БББ [215], људски докази који директно повезују вишак проупалних цитокина са еНОС дисфункцијом и / или оштећењем БББ су недостаје.
Слика и лечење упале код психијатријске болести
Имагинг Неуроинфламматион Ин Ситу
Клинички, снимање неуроинфламе може се показати кључним за идентификовање подгрупе психијатријских пацијената са неуроинфламаторима који ће највероватније повољно реаговати на имуномодулаторне терапије. Поред тога, такво сликање може омогућити клиничарима да надгледају активност болести повезане са неуроинфламатом и њен одговор на имунолошку терапију код психијатријских пацијената. Упале у људском мозгу традиционално зависе од МРИ или ЦТ визуализације екстравагираних интравенских контрастних средстава, што указује на локализовани слом БББ-а. МРИ побољшани гадолинијумом повремено показује такав слом у лимбичким регионима повезан са емоционалном обрадом код пацијената са психијатријским поремећајима који се могу приписати паранеопластичним или другим енцефалитидима [107,109,113]. Колико нам је познато, међутим, ненормално побољшање никада није демонстрирано ни у једном класичном психијатријском поремећају [21,214,232], упркос функционалним [214,216] и ултраструктурним БББ абнормалностима [60].
Остаје непознато да ли се суптилније неуроинфламе могу визуелизовати ин виво код класичних психијатријских поремећаја. Једна од обећавајућих техника је позитронска емисиона томографија (ПЕТ) која користи радио-пратиоце, попут Ц11-ПК11195, који се везују за протеин транслокатор, раније познат као периферни бензодиазепински рецептор, изражен активираном микроглијом [233,234].
Користећи ову методу, показало се да пацијенти са шизофренијом имају већу активацију микроглија у целој кори [235] и у хипокампусу током акутне психозе [236]. Једна студија (14 шизофренија, 14 контрола) није пронашла значајну разлику између везивања [11Ц] ДАА1106 код шизофреније у односу на контроле, већ директну корелацију између везивања [11Ц] ДАА1106 и тежине позитивних симптома и трајања болести код шизофреније [236].
Истраживачи из наше установе су користили Ц11-ПК11195 ПЕТ да би демонстрирали упалу бихипокампуса код пацијената са неуропсихијатријском дисфункцијом, укључујући психотични МДД, епилепсију и антероградну амнезију, повезане са анти-ГАД антителима [237]. Међутим, ПК11195 ПЕТ има�ниска својства сигнал-шум и захтева циклотрон на лицу места.
Сходно томе, истраживање је посвећено развоју побољшаних протеинских лиганда транслокатора за ПЕТ и СПЕЦТ. Будуће снажне пост-мортем студије можданих ткива које користе квантификацију протеина усмерене на разјашњавање метаболичких и инфламаторних путева, цитокина ЦНС-а и њихових рецептора везивања у психијатријским поремећајима су потребне да би се унапредило наше разумевање аутоимуне патофизиологије.
Улога антиинфламаторних лекова у психијатријским поремећајима
Неколико студија на људима и животињама сугерише да одређени антиинфламаторни лекови могу играти важну помоћну улогу у лечењу психијатријских поремећаја (Табела 3). Уобичајени лекови су инхибитори циклооксигеназе (табела 3) [238-245], миноциклин (табела 3) [240-245], омега-3 масне киселине [246,247] и неуростероиди [248].
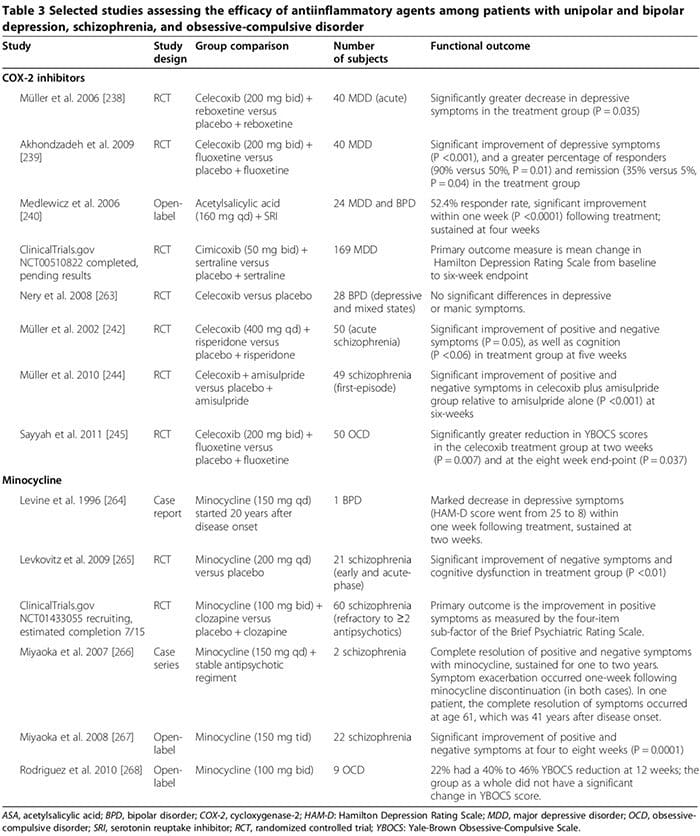 Неколико студија на људима показало је да инхибитори ЦОКС-2 могу побољшати психијатријске симптоме МДД, БПД, шизофреније и ОЦД (Табела 3) [248]. Супротно томе, помоћно лечење неселективним ЦОКС инхибиторима (то јест нестероидним антиинфламаторним лековима (НСАИД)) може смањити ефикасност ССРИ [249,250]; два велика испитивања известила су да је излагање НСАИЛ (али не селективним инхибиторима ЦОКС-2 или салицилатима) повезано са значајним погоршањем депресије међу подгрупом учесника студије [249,250].
Неколико студија на људима показало је да инхибитори ЦОКС-2 могу побољшати психијатријске симптоме МДД, БПД, шизофреније и ОЦД (Табела 3) [248]. Супротно томе, помоћно лечење неселективним ЦОКС инхибиторима (то јест нестероидним антиинфламаторним лековима (НСАИД)) може смањити ефикасност ССРИ [249,250]; два велика испитивања известила су да је излагање НСАИЛ (али не селективним инхибиторима ЦОКС-2 или салицилатима) повезано са значајним погоршањем депресије међу подгрупом учесника студије [249,250].
У првом испитивању, које је обухватило 1,258 депресивних пацијената лечених циталопрамом током 12 недеља, стопа ремисије била је значајно нижа међу онима који су узимали НСАИД бар једном у односу на оне који нису (45% наспрам 55%, ОР 0.64, П = 0.0002) [249]. Друго испитивање, које је обухватило 1,545 испитаника са МДД-ом, показало је да је стопа депресије резистентне на лечење била знатно већа међу онима који су узимали НСАИЛ (ОР 1.55, 95% ЦИ 1.21 до 2.00) [231]. Погоршање депресије у НСАИД групама можда није механички повезано са терапијом НСАИД-има, већ је повезано са постојећим хроничним медицинским стањима [10,12-18] која захтевају дуготрајне НСАИД-ове и за која је познато да су независно повезана са повећан ризик од депресије резистентне на лечење [249,251]. Потребне су будуће студије које истражују утицај НСАИЛ на депресију и одговор на антидепресиве код људи.
У другим експерименталним студијама које су користиле парадигме акутног стреса за изазивање стања налик депресији код мишева, циталопрам је повећао ТНФ-?, ИФН-? и п11 (молекуларни фактор повезан са депресивним понашањем код животиња) у фронталном кортексу, док је НСАИЛ ибупрофен смањио ове молекуле; НСАИЛ су такође ослабили антидепресивне ефекте ССРИ, али не и других антидепресива [249]. Ови налази сугеришу да проинфламаторни цитокини могу парадоксално да испоље антидепресивне ефекте упркос огромним доказима изстудије на људима показују супротно (као што је горе рецензирано), које се могу ублажити НСАИЛ [249]. Најмање два разматрања могу објаснити овај очигледан парадокс: 1) у неким експерименталним условима, проинфламаторни цитокини су повезани са неуропротективном улогом, [251; (за�пример, ИФН-? у ниским нивоима може да индукује неуропротективну микроглију (слика 2) [163,166,251]); и 2) да ли су ови одговори уочени у контексту парадигме акутног стреса на животињском моделу применљиви на ендогени МДД код људи остаје нејасно [251].
Терапијски ефекти ЦОКС-2 инхибитора у психијатријским поремећајима могу да укључују модулацију биосинтезе простагландина изведених из ЦОКС-2, укључујући проинфламаторни ПГЕ2 и антиинфламаторни 15-деокси-? 12,14-ПГЈ2 (15д-ПГЈ2) [252,253]. Инхибитори ЦОКС-2 могу смањити упалу посредовану ПГЕ2, што може допринети патофизиологији психијатријских поремећаја [252,253]. Они такође могу да промене нивое 15д-ПГЈ2 и активност његовог нуклеарног рецептора пероксизом пролифератора активираног нуклеарног рецептора гама (ППАР-?) [252,253].
Неколико студија сугерише да 15д-ПГЈ2 и његов нуклеарни рецептор ППАР-? могу послужити као биолошки маркери за шизофренију [253]. Код шизофрених пацијената, нивои ПГЕ2 у серуму су повећани, док су нивои 15д-ПГЈ2 у серуму смањени, као и експресија његовог нуклеарног рецептора ППАР-? у ПБМЦ [252]. Док ЦОКС-2 инхибитори могу ограничити потенцијално корисне антиинфламаторне ефекте ЦОКС-2-зависног �15д-ПГЈ2/ППАР-? пута�, могу повољно да смање његове штетне ефекте, укључујући 1) повећан ризик од инфаркта миокарда и одређених инфекција (на пример, цитомегаловирус и Токопласма гондии) код шизофрених пацијената [254] и 2) његове про-апоптотичке ефекте примећене у хумано и животињско ткиво рака [255]. Други потенцијални механизми терапијских ефеката инхибитора ЦОКС-2 могу укључивати њихову способност да смање нивое проинфламаторних цитокина [163], ограниче ексцитотоксичност хинолинске киселине (као код МДД) и смање нивое КИНА (као код шизофреније) [128].
Миноциклин може бити ефикасан код психијатријских поремећаја (Табела 3) [248]. Подаци ин витро сугеришу да миноциклин инхибира МАП, секрецију цитокина, �ЦОКС-2/ПГЕ-2 експресију� и индуцибилну синтазу азот оксида [256]. Миноциклин такође може да се супротстави нерегулисаној глутаматергијској и допаминергичкој неуротрансмисији [256].
Ефикасност омега-3 масних киселина код психијатријских поремећаја је нејасна [248]. У мета-анализи из 2011. године 15 рандомизовано контролисаних студија (916 МДД), омега-3 суплементи који садрже еикозапентаенску киселину ≥60% (опсег дозе од 200 до 2,200 мг/д изнад дозе докозахексаенске киселине) значајно су смањили симптоме депресије као додатна терапија за СРИ (П <0.001) [246]. Накнадна мета-анализа је, међутим, закључила да нема значајне користи од омега-3 масних киселина у депресији и да је наводна ефикасност само резултат пристрасности у публикацији [247]. Мета-анализа из 2012. 5 рандомизованих контролисаних студија укључујући 291 учесника БПД-а открила је да су симптоми депресије, али не и манични, значајно побољшани међу онима који су рандомизовани на омега-3 масне киселине у односу на оне који су узимали плацебо (Хедгес г 0.34, П = 0.025) [257]. У рандомизованом контролисаном испитивању шизофрених субјеката праћених до 12 месеци, и позитивни и негативни резултати симптома су значајно смањени међу 66 учесника рандомизованих на дуголанчане омега-3 (1.2 г/дан током 12 недеља; П = 0.02 и 0.01, односно) [258]; тхе�аутори су закључили да повећање омега-3 током раног тока шизофреније такође може спречити релапсе и напредовање болести [258].
Метаанализа седам рандомизираних контролисаних испитивања из 2012. године која је процењивала повећање омега-3 код 168 шизофрених пацијената није пронашла корист од лечења [259]. Аутори ове мета-анализе посебно су изјавили да се не могу извести закључци у вези са крајњим тачкама превенције релапса или прогресије болести [259]. Експериментални подаци сугеришу да еикозапентаенојска киселина и докозахексаенојска киселина посредују у њиховом противупалном дејству промовишући синтезу ресовина и протеина, који могу инхибирати инфилтрацију леукоцита и смањити производњу цитокина [248].
Неуростероиди, укључујући прегненолон и његов даљи метаболит алопрегнанолон, могу имати корисну улогу у неким психијатријским поремећајима [248,260]. У МДД, неколико студија открило је смањење нивоа алопрегнанолона у плазми / ликвору у корелацији са озбиљношћу симптома, који се нормализовао након успешног лечења одређеним антидепресивима (на пример, ССРИ) и електроконвулзивне терапије [261]. У шизофренији, ниво прегненолона у мозгу може се променити [248], а ниво серумског алопрегнанолона може се повећати након неких антипсихотичних лекова (на пример, клозапина и оланзапина) [260]. У три рандомизирана контролисана испитивања (100 шизофреније (удружених); трајање лечења, приближно девет недеља) позитивни, негативни и когнитивни симптоми, као и екстрапирамидални нежељени ефекти антипсихотичара су значајно побољшани у једном или више испитивања међу онима рандомизираним на прегненолон у односу на оне који су примали плацебо [248]. У једном испитивању, побољшање је одржано дуготрајним лечењем прегненолоном [248]. Прегненолон може да регулише когницију и понашање појачавањем функције НМДА и ГАБАА рецептора [248]. Даље, алопрегнанолон може да има неуропротективне и антиинфламаторне ефекте [248]. Потребно је више РЦТ студија како би се потврдила корисна улога неуроактивних стероида у раним психијатријским поремећајима код људи.
Чекамо резултате неколико текућих клиничких испитивања која истражују терапеутске ефекте других антиинфламаторних средстава, укључујући салицилат, инхибитор НФ-Б (НЦТ01182727); ацетилсалицилна киселина (НЦТ01320982); правастатин (НЦТ1082588); и декстрометорфан, неконкурентни НМДАР антагонист који може ограничити допаминергично оштећење неурона изазвано упалом (НЦТ01189006).
Будуће стратегије лечења
Иако су тренутне имунолошке терапије (на пример, ИВИГ, плазмафереза, кортикостероиди и имуносупресивни агенси) често ефикасне за лечење аутоимуних енцефалитида код којих је упала акутна, интензивна и претежно адаптивног порекла, њихова ефикасност код класичних психијатријских поремећаја код којих је умного блажи и претежно урођеног порекла је ограничен [2]. Развој нових терапеутских средстава требало би да има за циљ преокретање глијалног губитка [46,138], смањујући штетни МАП, истовремено оптимизујући ендогене неуропротективне Т регистре и корисни МАП, уместо да неселективно сузбија запаљење као што је то случај са тренутним имуносупресивним агенсима. Поред тога, потребан је развој снажних ко-адјувантних антиоксиданата који би преокренули оксидативне повреде код психијатријских поремећаја.
Закључци
Аутоимунитет може изазвати мноштво неуропсихијатријских поремећаја који се у почетку могу јавити са изолованим психијатријским симптомима. Урођена упала / аутоимунитет могу бити релевантни за патогенезу психијатријских симптома у подгрупи пацијената са класичним психијатријским поремећајима. Урођена упала може бити механички повезана са традиционалним моноаминергичким и глутаматергичним абнормалностима и повећаним оксидативним повредама забележеним у психијатријским болестима.
Соухел Најјар1,5 *, Даниел М Пеарлман2,5, Кеннетх Алпер4, Аманда Најјар3 и Оррин Девински1,4,5
Скраћенице
3-ОХ-КИН: 3-хидрокси-кинуренин; ?7нАцхР: Алфа 7 никотински ацетилхолински рецептори; АМПАР: рецептори амино-3-хидрокси-5-метил-л-4-изоксазолпропионске киселине; АПЦ: ћелија која представља антиген; БББ: крвно-мождана баријера;
БХ4: тетрахидробиоптерин; БПД: Биполарни поремећај; ЦИ: Интервал поверења;
ЦНС: Централни нервни систем; ЦОКС-2: циклооксегеназа-2; Ликвор: Цереброспинална течност; ДСМ-ИВ: Дијагностички и статистички приручник за менталне поремећаје, четврто издање; ЕААТ: Побудни транспортери аминокиселина; еНОС: ендотелна азот-оксид-синтаза; ГАБАБ: гама аминомаслена киселина-бета; ГАД: декарбоксилаза глутаминске киселине; ГФАП: Глијални фибриларни кисели протеин; ГЛКС: 4Х МРС детектујући глутамат, глутамин, композит гама аминомаслачне киселине;
ИДО: Индолеамин 2,3-диоксигеназа; Иг: Имуноглобулин; ИЛ: Интерлеукин; ИЛ-1РА: антагонист рецептора за интерлеукин 1; ИФН- ?: Интерферон гама;
КАТ: Кинуренине аминотрансфераза; КМО: кинуренин 3-монооксигеназа; КИН: Кинуренине; КИНА: Кинурениц ацид; ЛЕ: Лимбички енцефалитис;
ЛПС: Липополисахарид; КАРТА: Микроглијска активација и пролиферација;
МДД: Велики депресивни поремећај; мГлуР: Метаботропни глутаматни рецептор; МХЦ: ИИ Главни комплекс хистокомпатибилности класа два; МРИ: снимање магнетном резонанцом; МРС: Спектроскопија магнетне резонанце; НФ-? Б: нуклеарни фактор капа Б; НМДАР: Н-метил-Д-аспартатни рецептор; НР1: Место глицина;
ОКП: опсесивно-компулзивни поремећај; ИЛИ: Однос шансе; ПАНДАС: Педијатријски неуропсихијатријски аутоимуни поремећаји повезани са стрептококним инфекцијама; ПБМЦ: мононуклеарне ћелије периферне крви; ПЕТ: Позитронска емисиона томографија; ПФЦ: Префронтални кортекс; ПГЕ-2: Простагландин Е2; ППАР-
?: Гама нуклеарних рецептора активираних пролифератором пероксизома; КА: Кинолинска киселина; РНС: врсте реактивног азота; РОС: реактивне врсте кисеоника;
сИЛ: растворљиви интерлеукин; СЛЕ: Системски еритемски лупус; СРИ: инхибитор поновног преузимања серотонина; ТНФ- ?: Фактор некрозе тумора алфа; Т-рег: ЦД4 + ЦД25 + ФОКСП3 + Т регулаторне ћелије; ТДО: триптофан-2,3-диоксигеназа; Тх: Т-помагач; ВГКЦ: Калијумски канал напонски ослабљен; КСАГ-: Глутамат аспартат транспортер; Ксц-: астроглијски глутамат / цистин, независан од натријума
систем антипортера
Такмичарски интереси
Аутори изјављују да немају супротстављене интересе.
Прилози аутора
СН и ДМП су извршили опсежни преглед литературе, протумачили податке, припремили рукопис, слике и табеле. КА је припремио одељак који се односи на оксидативне механизме и допринео ревизији рукописа. АН и ОД критички су ревидирани и побољшани дизајн и квалитет рукописа. Сви аутори су прочитали и одобрили коначни рукопис.
priznanja
Захваљујемо се др. Јосеп Далмау, др. Мед., Др. Траци Бутлер, др. Мед., И др. Давид Зазаг, др. Мед., За пружање стручности у аутоимуним енцефалитидима, сликању неуроинфламаторних болести и неуропатологији.
Аутор� Детаљи
1 Департман за неурологију, Медицински факултет Универзитета у Њујорку, 550 Фирст Авенуе, Њујорк, НИ 10016, САД. 2Геисел Сцхоол оф Медицине, Дартмоутх, Тхе Дартмоутх Институте фор Хеалтх Полици анд Цлиницал Працтице, Лафаиетте Стреет 30, ХБ 7252, Либан, НХ 03766, УСА. 3Д одељење за патологију, Одељење за неуропатологију, Медицински факултет Универзитета у Њујорку, 550 Фирст Авенуе, Њујорк, НИ 10016, САД. 4 Катедра за психијатрију, Медицински факултет Универзитета Њујорк, Њујорк, Њујорк, САД. 5 Универзитетски свеобухватни центар за епилепсију Универзитета Њујорк, 550 Фирст Авенуе, Њујорк, НИ 10016, САД.
Бланк
Референце:
1. Каисер МС, Далмау Ј: Нова веза између аутоимуних поремећаја
и неуропсихијатријске болести. Ј Неуропсицхиатри Цлин Неуросци 2011, 23:90.
2. Најјар С, Пеарлман Д, Загзаг Д, Голфинос Ј, Девински О: Глутаминска киселина
синдром аутоантитела на декарбоксилазу који се представља као шизофренија.
Неуролог 2012, 18:88�91.
3. Граус Ф, Саиз А, Далмау Ј: Антитела и неуронске аутоимуне
поремећаји ЦНС-а. Ј Неурол 2010, 257:509�517.
4. Леннок БР, Цолес АЈ, Винцент А: Енцефалитис посредован антителима: а
узрок шизофреније који се може лечити. Бр Ј Психијатрија 2012, 200:92.
5. Занди МС, Ирани СР, Ланг Б, Ватерс П, Јонес ПБ, МцКенна П, Цолес АЈ, Винцент
А, Леннок БР: Аутоантитела релевантна за болест у првој епизоди
шизофренија. Ј Неурол 2011, 258:686�688.
6. Баталлер Л, Клеопа КА, Ву ГФ, Росси ЈЕ, Росенфелд МР, Далмау Ј:
Аутоимунски лимбични енцефалитис код 39 пацијената: имунофенотипи и
исходи. Ј Неурол Неуросург Псицхиатри 2007, 78:381-385.
7. Дале РЦ, Хеиман И, Гиованнони Г, Цхурцх АВ: Инциденција анти-мозга
антитела код деце са опсесивно-компулзивним поремећајем. Бр Ј Психијатрија
2005, 187:314�319.
8. Кендлер КС: Шарена природа узрока психијатријских болести: замена
органско-функционална / хардверско-софтверска дихотомија са емпиријски
заснован плурализам. Мол Псицхиатри 2012, 17:377�388.
9. Кескин Г, Сунтер Г, Миди И, Тунцер Н: Неуросифилис као узрок когнитивног
опадање и психијатријски симптоми у млађем узрасту. Ј Клиника за неуропсихијатрију
Неуросци 2011, 23:Е41�Е42.
10. Лебоиер М, Сореца И, Сцотт Ј, Фрие М, Хенри Ц, Тамоуза Р, Купфер ДЈ: Цан
биполарни поремећај посматрати као мулти-системску инфламаторну болест?
Ј Аффецт Дисорд 2012, 141:1�10.
11. Хацкетт МЛ, Иапа Ц, Параг В, Андерсон ЦС: Учесталост депресије након
мождани удар: систематски преглед опсервационих студија. Строке 2005, 36:1330�1340.
12. Дантзер Р, О'Цоннор ЈЦ, Фреунд ГГ, Јохнсон РВ, Келлеи КВ: Од
упала до болести и депресије: када имуни систем
потчињава мозак. Нат Рев Неуросци 2008, 9:46.
13. Ласке Ц, Занк М, Клеин Р, Странски Е, Батра А, Буцхкремер Г, Сцхотт К:
Реактивност аутоантитела у серуму пацијената са великом депресијом,
шизофренија и здраве контроле. Псицхиатри Рес 2008, 158:83�86.
14. Еисенбергер НИ, Беркман ЕТ, Инагаки ТК, Рамесон ЛТ, Масхал НМ, Ирвин МР:
Анхедонија изазвана упалом: ендотоксин смањује вентрални стриатум
одговори на награду. Биол Псицхиатри 2010, 68:748�754.
15. Хароон Е, Раисон ЦЛ, Миллер АХ: Психонеуроимунологија се састаје
неуропсихопармакологија: транслационе импликације утицаја
запаљење на понашању. Неуропсицхопхармацологи 2012, 37:137�162.
16. Бенрос МЕ, Ниелсен ПР, Нордентофт М, Еатон ВВ, Далтон СО, Мортенсен ПБ:
Аутоимуне болести и тешке инфекције као фактори ризика за
шизофренија: 30-годишње истраживање регистра засновано на популацији. Ам Ј Психијатрија
2011, 168:1303�1310.
17. МцНалли Л, Бхагвагар З, Ханнестад Ј: Запаљење, глутамат и глија
у депресији: преглед литературе. ЦНС Спецтр 2008, 13:501�510.
18. Харрисон НА, Бридон Л, Валкер Ц, Граи МА, Стептое А, Цритцхлеи ХД:
Запаљење изазива промене расположења кроз промене у субгенилу
активност цингулата и мезолимбична повезаност. Биол психијатрија 2009,
66:407�414.19. Раисон ЦЛ, Миллер АХ: Да ли је депресија инфламаторни поремећај?
Цурр Псицхиатри Реп 2011, 13:467�475.
20. Раисон ЦЛ, Миллер АХ: Еволуцијски значај депресије у
Одбрана домаћина од патогена (ПАТХОС-Д). Мол Психијатрија 2013, 18:15.
21. Стеинер Ј, Богертс Б, Сарниаи З, Валтер М, Гос Т, Бернстеин ХГ, Миинт АМ:
Премошћавање јаза између имунолошке и глутаматне хипотезе
шизофренија и велика депресија: потенцијална улога глиалног НМДА
модулатори рецептора и оштећен интегритет крвно-мождане баријере. Свет Ј
Биол Псицхиатри 2012, 13:482�492.
22. Стеинер Ј, Маврин Ц, Зиегелер А, Биелау Х, Уллрицх О, Бернстеин ХГ, Богертс Б:
Дистрибуција ХЛА-ДР позитивне микроглије у шизофренији одражава се
поремећена церебрална латерализација. Ацта Неуропатхол 2006, 112:305.
23. Папакостас ГИ, Схелтон РЦ, Кинрис Г, Хенри МЕ, Баков БР, Липкин СХ, Пи Б,
Тхурмонд Л, Билелло ЈА: Процена вишеструког испитивања на бази серума
биолошки дијагностички тест за велики депресивни поремећај: пилот и
студија репликације. Мол Психијатрија 2013, 18:332�339.
24. Крисхнан Р: Униполарна депресија код одраслих: епидемиологија, патогенеза и
неуробиологија. У УпТоДате. Уредио Басов ДС. Валтхам, МА: УпТоДате; 2013.
25. Стовалл Ј: Биполарни поремећај код одраслих: епидемиологија и дијагноза. У
Савремен. Уредио Басов ДС. УпТоДате: Валтхам; 2013.
26. Фисцхер БА, Буцханан РВ: Шизофренија: епидемиологија и патогенеза.
У УпТоДате. Уредио Басов ДС. Валтхам, МА: УпТоДате; 2013.
27. Нестадт Г, Самуелс Ј, Риддле М, Биенвену ОЈ 3рд, Лианг КИ, ЛаБуда М,
Валкуп Ј, Градос М, Хоехн-Сариц Р: Породична студија опсесивно-компулзивног
поремећај. Арцх Ген Псицхиатри 2000, 57:358�363.
28. Стефанссон Х, Опхофф РА, Стеинберг С, Андреассен ОА, Цицхон С, Рујесцу Д,
Верге Т, Пиетилаинен ОП, Морс О, Мортенсен ПБ, Сигурдссон Е, Густафссон О,
Ниегаард М, Туулио-Хенрикссон А, Ингасон А, Хансен Т, Сувисаари Ј,
Лоннквист Ј, Паунио Т, Бирглум АД, Хартманн А, Финк-Јенсен А, Нордентофт
М, Хоугаард Д, Норгаард-Педерсен Б, Бетцхер И, Олесен Ј, Бреуер Р, Мллер
ХЈ, Гиеглинг И, ет ал: Уобичајене варијанте које носе ризик од шизофреније.
Натуре 2009, 460:744�747.
29. Мллер Н, Сцхварз МЈ: Имунски посредована промена серотонина и
глутамат: ка интегрисаном погледу на депресију. Мол Псицхиатри
2007, 12:988�1000.
30. Галецки П, Флорковски А, Биенкиевицс М, Сземрај Ј: Функционални полиморфизам
гена циклооксигеназе-2 (Г-765Ц) код пацијената са депресијом.
Неуропсицхобиологи 2010, 62:116�120.
31. Левинсон ДФ: Генетика депресије: преглед. Биол психијатрија 2006,
60:84�92.
32. Зхаи Ј, Цхенг Л, Донг Ј, Схен К, Зханг К, Цхен М, Гао Л, Цхен Кс, Ванг К,
Денг Кс, Ксу З, Ји Ф, Лиу Ц, Ли Ј, Донг К, Цхен Ц: ген С100Б
полиморфизми предвиђају префронталну просторну функцију код обе шизофреније
пацијената и здравих особа. Сцхизопхр Рес 2012, 134:89�94.
33. Зхаи Ј, Зханг К, Цхенг Л, Цхен М, Ванг К, Лиу И, Денг Кс, Цхен Кс, Схен К,
Ксу З, Ји Ф, Лиу Ц, Донг К, Цхен Ц, Ли Ј: Варијанте ризика у гену С100Б,
повезане са повишеним нивоима С100Б, такође су повезане са
визуелно-просторни инвалидитет шизофреније. Бехав Браин Рес 2011, 217:363�368.
34. Цаппи Ц, Муниз РК, Сампаио АС, Цордеиро К, Брентани Х, Палациос СА,
Маркуес АХ, Валлада Х, Мигуел ЕЦ, Гуилхерме Л, Хоуние АГ: Удружење
студија између функционалних полиморфизама у гену ТНФ-алфа и
опсесивно компулзивни поремећај. Арк Неуропсикуиатр 2012, 70:87�90.
35. Мигуел-Хидалго ЈЈ, Бауцом Ц, Диллеи Г, Оверхолсер ЈЦ, Мелтзер ХИ,
Стоцкмеиер ЦА, Рајковска Г: Глиални фибриларни кисели протеин
имунореактивност у префронталном кортексу разликује млађе од
старије особе у великом депресивном поремећају. Биол Псицхиатри 2000, 48:861-873.
36. Алтсхулер ЛЛ, Абулсеоуд ОА, Фоланд Росс Л, Бартзокис Г, Цханг С, Минтз Ј,
Хеллеманн Г, Винтерс ХВ: Смањење астроцита амигдале код испитаника са
велики депресивни поремећај, али не и биполарни поремећај. Биполар Дисорд 2010,
12:541�549.
37. Вебстер МЈ, Кнабле МБ, Јохнстон-Вилсон Н, Нагата К, Инагаки М, Иолкен РХ:
Имунохистохемијска локализација фосфорилиране глијасте фибриларне киселине
протеин у префронталном кортексу и хипокампусу код пацијената са
шизофренија, биполарни поремећај и депресија. Браин Бехав Иммун 2001,
15:388�400.
38. Доиле Ц, Деакин ЈФВ: Мање астроцита у фронталном кортексу код шизофреније,
депресија и биполарни поремећај. Сцхизопхрениа Рес 2002, 53: 106.
39. Јохнстон-Вилсон НЛ, ЦД Симс, Хофманн ЈП, Андерсон Л, Схоре АД, Торреи
ЕФ, Иолкен РХ: Промене специфичне за болест у протеинима мозга фронталног кортекса
код шизофреније, биполарног поремећаја и великог депресивног поремећаја, Тхе
Станлеи неуропатолошки конзорцијум. Мол Псицхиатри 2000, 5:142-149.
40. Госселин РД, Гибнеи С, О'Маллеи Д, Динан ТГ, Цриан ЈФ: Специфично за регион
смањење имунореактивности глиалних фибриларних киселих протеина у мозгу
пацовски модел депресије. Неуросциенце 2009, 159:915-925.
41. Банаср М, Думан РС: Глијални губитак у префронталној кори је довољан да
изазивају депресивно понашање. Биол Псицхиатри 2008, 64:863-870.
42. Цоттер Д, Худсон Л, Ландау С: Докази о орбитофронталној патологији у
биполарни поремећај и велика депресија, али не и код шизофреније.
Биполарни поремећај 2005, 7:358�369.
43. Брауцх РА, Аднан Ел-Масри М, Паркер Ј Јр, Ел-Маллакх РС: Број глијалне ћелије
и однос неурона / глијалних ћелија у постмортем мозгу биполарних појединаца.
Ј Аффецт Дисорд 2006, 91:87�90.
44. Цоттер ДР, Парианте ЦМ, Евералл ИП: Главне абнормалности глијалних ћелија
психијатријски поремећаји: докази и импликације. Браин Рес Булл 2001,
55:585�595.
45. Цоттер Д, Мацкаи Д, Ландау С, Кервин Р, Евералл И: Смањена густина глија ћелија
и величина неурона у предњем цингуластом кортексу код велике депресије
поремећај. Арцх Ген Псицхиатри 2001, 58:545�553.
46. Бовлеи МП, Древетс ВЦ, Онг'р Д, Прице ЈЛ: Ниски глијални бројеви у
амигдала код великог депресивног поремећаја. Биол Псицхиатри 2002, 52:404�412.
47. Торо ЦТ, Халлак ЈЕ, Дунхам ЈС, Деакин ЈФ: Глијални фибриларни кисели протеин и
глутамин синтетаза у подрегијама префронталног кортекса у шизофренији
и поремећај расположења. Неуросци Летт 2006, 404:276�281.
48. Рајковска Г, Мигуел-Хидалго ЈЈ, Маккос З, Мелтзер Х, Оверхолсер Ј,
Стоцкмеиер Ц: Смањење специфичне за слојеве ГФАП-реактивне астроглије у
дорсолатерални префронтални кортекс код шизофреније. Сцхизопхр Рес 2002, 57:127�138.
49. Стеффек АЕ, МцЦуллумсмитх РЕ, Хароутуниан В, Меадор-Воодруфф ЈХ: Кортикал
експресија глија фибриларних киселих протеина и глутамин синтетазе је
смањен код шизофреније. Сцхизопхр Рес 2008, 103:71�82.
50. Дамаџић Р, Бигелов ЛБ, Кример ЛС, Голденсон ДА, Саундерс РЦ, Клеинман
ЈЕ, Херман ММ: Квантитативно имунохистохемијско проучавање астроцита у
енторинални кортекс код шизофреније, биполарног поремећаја и мајора
депресија: одсуство значајне астроцитозе. Браин Рес Булл 2001, 55:611-618.
51. Бенес ФМ, МцСпаррен Ј, Бирд ЕД, СанГиованни ЈП, Винцент СЛ: Дефицити у
мали интернеурони у префронталним и цингулама кортекса шизофреника
и шизоафективних пацијената. Арцх Ген Псицхиатри 1991, 48:996�1001.
52. Мллер Н, Сцхварз МЈ: Имуни систем и шизофренија. Цурр Иммунол
Рев 2010, 6:213�220.
53. Стеинер Ј, Валтер М, Гос Т, Гуиллемин ГЈ, Бернстеин ХГ, Сарниаи З, Маврин Ц,
Брисцх Р, Биелау Х, Меиер Зу Сцхвабедиссен Л, Богертс Б, Миинт АМ: озбиљно
депресија је повезана са повећаном микроглијалном кинолинском киселином у
подрегије предњег цингулативног гируса: докази за имунемодулирану
глутаматергична неуротрансмисија? Ј Неуроинфламматион 2011, 8:94.
54. Востриков ВМ, Уранова НА, Орловскаја ДД: Дефицит перинеурона
олигодендроцити у префронталном кортексу код шизофреније и расположења
поремећаји. Сцхизопхр Рес 2007, 94:273�280.
55. Рајковска Г, Мигуел-Хидалго ЈЈ: Глиогенеза и глија патологија у
депресија. ЦНС Неурол Дисорд Друг Таргетс 2007, 6:219�233.
56. Уранова НА, Востриков ВМ, Орловскаја ДД, Рахманова ВИ:
Олигодендроглиална густина у префронталном кортексу код шизофреније и
поремећаји расположења: студија Станлеи Неуропатхологи Цонсортиум-а.
Сцхизопхр Рес 2004, 67:269.
57. Уранова Н: Оштећење и губитак олигодендроцита су пресудни у
патогенеза шизофреније и поремећаји расположења (облици налаза
постмортем студије). Неуропсицхопхармацологи 2004, 29: С33.
58. Уранова НА, Орловскаја ДД, Востриков ВМ, Рахманова ВИ: Смањено
густина олигодендроглиалних сателита пирамидалних неурона у слоју ИИИ у
префронтални кортекс код шизофреније и поремећаја расположења. Сцхизопхр Рес
2002, 53: 107.
59. Востриков ВМ, Уранова НА, Ракхманова ВИ, Орловскаиа ДД: Снижено
густина олигодендроглиалних ћелија у префронталном кортексу код шизофреније.
Зх Неврол Псикхиатр Им СС Корсакова 2004, 104:47�51.
60. Уранова НА, Зимина ИС, Викхрева ОВ, Круков НО, Рахманова ВИ, Орловскаја
ДД: Ултраструктурно оштећење капилара у неокортексу у
шизофренија. Ворлд Ј Биол Псицхиатри 2010, 11:567�578.
61. Хоф ПР, Хароутуниан В, Фриедрицх ВЛ Јр, Бине В, Буитрон Ц, Перл ДП, Давис КЛ:
Губитак и измењена просторна расподела олигодендроцита у супериорном
фронтални гирус код шизофреније. Биол Псицхиатри 2003, 53:1075�1085.
62. Давис КЛ, Стеварт ДГ, Фриедман ЈИ, Буцхсбаум М, Харвеи ПД, Хоф ПР,
Букбаум Ј, Хароутуниан В: Промене беле материје код шизофреније:
докази за дисфункцију повезану са мијелином. Арцх Ген Псицхиатри 2003,
60:443�456.63. Флинн СВ, Ланг ДЈ, Мацкаи АЛ, Гогхари В, Вавасоур ИМ, Вхитталл КП, Смитх
ГН, Аранго В, Манн ЈЈ, Дворк АЈ, Фалкаи П, Хонер ВГ: Абнормалности
мијелинизација код шизофреније откривена ин виво помоћу МРИ и постмортем
са анализом протеина олигодендроцита. Мол Псицхиатри 2003,
8:811�820.
64. Уранова НА, Востриков ВМ, Викхрева ОВ, Зимина ИС, Коломеетс НС, Орловскаја
ДД: Улога патологије олигодендроцита у шизофренији. Инт Ј
Неуропсицхопхармацол 2007, 10:537-545.
65. Бине В, Кидкарднее С, Татусов А, Иианноулос Г, Буцхсбаум МС,
Хароутуниан В: Смањење неуронског и шизофреније повезаног
бројеви олигодендроцита у предњем главном језгру таламуса.
Сцхизопхр Рес 2006, 85:245.
66. Хамиди М, ВЦ Древетс, Цена ЈЛ: Глијално смањење амигдале у дуру
депресивни поремећај је због олигодендроцита. Биол психијатрија 2004,
55:563�569.
67. Баиер ТА, Буслеи Р, Хавас Л, Фалкаи П: Докази о активацији микроглије у
пацијенти са психијатријским обољењима. Неуросци Летт 1999, 271:126�128.
68. Стеинер Ј, Биелау Х, Брисцх Р, Данос П, Уллрицх О, Маврин Ц, Бернстеин ХГ,
Богертс Б: Имунолошки аспекти у неуробиологији самоубиства:
повишена густина микроглија код шизофреније и депресије је
повезан са самоубиством. Ј Псицхиатр Рес 2008, 42:151�157.
69. Рао ЈС, Харри ГЈ, Рапопорт СИ, Ким ХВ: Повећана екситотоксичност и
неуроинфламаторни маркери у постмортем фронталном кортексу из биполарног
болесници са поремећајем. Мол Псицхиатри 2010, 15:384�392.
70. Бернстеин ХГ, Стеинер Ј, Богертс Б: Глијалне ћелије код шизофреније:
патофизиолошки значај и могуће последице за терапију.
Екперт Рев Неуротхер 2009, 9:1059�1071.
71. Цхен СК, Тврдик П, Педен Е, Цхо С, Ву С, Спангруде Г, Цапеццхи МР:
Хематопоетско порекло патолошког неговања код мутираних мишева Хокб8.
Целл 2010, 141:775�785.
72. Антони ЈМ: Нега и раст уз микроглију. Сци Сигнал 2010, 3: јц8.
73. Воноди И, Стине ОЦ, Сатхиасаикумар КВ, Робертс РЦ, Митцхелл БД, Хонг ЛЕ,
Кајии И, Тхакер ГК, Сцхварцз Р: Регулирани кинуренин 3-
експресија гена монооксигеназе и активност ензима у шизофренији
и генетска повезаност са ендофенотиповима шизофреније. Арцх Ген
Психијатрија 2011, 68:665�674.
74. Раисон ЦЛ, Ловри ЦА, Роок ГА: Запаљење, санитација и
констернација: губитак контакта са коеволвираним, толерогеним
микроорганизми и патофизиологија и лечење главних
депресија. Арцх Ген Псицхиатри 2010, 67:1211�1224.
75. Дрекхаге РЦ, Хоогенбоезем ТХ, Верснел МА, Бергхоут А, Нолен ВА,
Дрекхаге ХА: Активација мрежа моноцита и Т ћелија код пацијената
са биполарним поремећајем. Браин Бехав Иммун 2011, 25:1206�1213.
76. Стеинер Ј, Јацобс Р, Пантели Б, Браунер М, Сцхилтз К, Бахн С, Хербертх М,
Вестпхал С, Гос Т, Валтер М, Бернстеин ХГ, Миинт АМ, Богертс Б: Акутни
шизофренију прати смањена Т ћелија и повећана Б ћелија
имунитет. Еур Арцх Псицхиатри Цлин Неуросци 2010, 260:509�518.
77. Ротге ЈИ, Аоуизерате Б, Тигнол Ј, Биоулац Б, Бурбауд П, Гуехл Д: Тхе
генетска имунолошка хипотеза заснована на глутамату у опсесивно-компулзивној
поремећај, Интегративни приступ од гена до симптома.
Неуросциенце 2010, 165:408�417.
78. И�ксел Ц, Онг�р Д: Студије спектроскопије магнетне резонанце
абнормалности у поремећајима расположења повезане са глутаматом. Биол психијатрија 2010,
68:785�794.
79. Рао ЈС, Келлом М, Реесе ЕА, Рапопорт СИ, Ким ХВ: Неуређени глутамат
и транспортери допамина у постмортем фронталном кортексу из биполарног
и шизофрених пацијената. Ј Аффецт Дисорд 2012, 136:63�71.
80. Бауер Д, Гупта Д, Харотуниан В, Меадор-Воодруфф ЈХ, МцЦуллумсмитх РЕ:
Ненормална експресија транспортера и транспортера глутамата
молекули у интеракцији у префронталном кортексу код старијих пацијената са
шизофренија. Сцхизопхр Рес 2008, 104:108�120.
81. Матуте Ц, Мелоне М, Валлејо-Илларраменди А, Цонти Ф: Повећана експресија
астроцитног транспортера глутамата ГЛТ-1 у префронталном кортексу
шизофреничари. 2005, 49:451�455.
82. Смитх РЕ, Хароутуниан В, Давис КЛ, Меадор-Воодруфф ЈХ: Израз
ексцитациони транскрипти транспортера аминокиселина у таламусу испитаника
са шизофренијом. Ам Ј Псицхиатри 2001, 158:1393-1399.
83. МцЦуллумсмитх РЕ, Меадор-Воодруфф ЈХ: Стријаталне ексцитационе аминокиселине
експресија транспортера транскрипта код шизофреније, биполарног поремећаја,
и велики депресивни поремећај. Неуропсицхопхармацологи 2002,
26:368�375.
84. Питтенгер Ц, Блоцх МХ, Виллиамс К: Глутаматне абнормалности код опсесивних
компулзивни поремећај: неуробиологија, патофизиологија и лечење.
Пхармацол Тхер 2011, 132:314�332.
85. Хасхимото К: Нова улога глутамата у патофизиологији
велики депресивни поремећај. Браин Рес Рев 2009, 61:105�123.
86. Хасхимото К, Сава А, Иио М: Повећани нивои глутамата у мозгу од
пацијенти са поремећајима расположења. Биол Псицхиатри 2007, 62:1310�1316.
87. Бурбаева Г, Боксха ИС, Турисхцхева МС, Воробиева ЕА, Савусхкина ОК,
Тересхкина ЕБ: Глутамин синтетаза и глутамат дехидрогеназа у
префронтални кортекс пацијената са шизофренијом. Прог
Неуропсицхопхармацол Биол Псицхиатри 2003, 27:675-680.
88. Бхаттацхарииа С, Кханна С, Цхакрабарти К, Махадеван А, Цхристопхер Р,
Сханкар СК: Ауто-антитела против мозга и измењена ексцитација
неуротрансмитери у опсесивно-компулзивном поремећају.
Неуропсицхопхармацологи 2009, 34:2489�2496.
89. Санацора Г, Гуеоргуиева Р, Епперсон ЦН, Ву ИТ, Аппел М, Ротхман ДЛ,
Кристал ЈХ, Масон ГФ: Подтипске промене гамаамино-маслачне киселине
киселине и глутамата код пацијената са великом депресијом.
Арцх Ген Псицхиатри 2004, 61:705-713.
90. Марсман А, ван ден Хеувел, МП, Кломп ДВ, Кахн РС, Луијтен ПР, Хулсхофф
Пол ХЕ: Глутамат у шизофренији: фокусирани преглед и метаанализа
студија 1Х-МРС. Сцхизопхр Булл 2013, 39:120�129.
91. Лиу И, Хо РЦ, Мак А: Интерлеукин (ИЛ) -6, фактор некрозе тумора алфа
(ТНФ-алфа) и растворљиви рецептори за интерлеукин-2 (сИЛ-2Р) су повишени у
пацијенти са великим депресивним поремећајем: мета-анализа и метарегрезија.
Ј Аффецт Дисорд 2012, 139:230�239.
92. Бриетзке Е, Стабеллини Р, Грассис-Оливеира Р, Лафер Б: Цитокини у биполару
поремећај: недавни налази, штетни ефекти, али обећавају за будућност
терапеутици. ЦНС спектар 2011. ввв.цнсспецтрумс.цом/аспк/
артицледетаил.аспк? артицлеид = 3596.
93. Денис Д, Флуитман С, Кавелаарс А, Хеијнен Ц, Вестенберг Х: Смањено
Активност ТНФ-алфа и НК у опсесивно-компулзивном поремећају.
Псицхонеуроендоцринологи 2004, 29:945-952.
94. Брамбилла Ф, Перна Г, Беллоди Л, Аранцио Ц, Бертани А, Перини Г, Царраро Ц, Гава
Ф: Концентрације фактора некрозе тумора у плазми интерлеукин-1 у
опсесивно-компулзивни поремећаји. Биол Псицхиатри 1997, 42:976-981.
95. Флуитман С, Денис Д, Вулинк Н, Сцхуттерс С, Хеијнен Ц, Вестенберг Х:
Производња цитокина изазвана липополисахаридима у опсесивно-компулзивном
поремећај и генерализовани поремећај социјалне анксиозности. Психијатрија
Рес 2010, 178:313�316.
96. Јанелидзе С, Маттеи Д, Вестрин А, Траскман-Бендз Л, Брундин Л: Цитокине
нивои у крви могу разликовати покушаје самоубистава од депресивног
пацијената. Браин Бехав Иммун 2011, 25:335�339.
97. Постал М, Цосталлат ЛТ, Аппензеллер С: Неуропсихијатријске манифестације у
системски еритематозни лупус: епидемиологија, патофизиологија и
менаџмент. ЦНС Другс 2011, 25:721-736.
98. Козора Е, Ханли ЈГ, Лаптева Л, Филлеи ЦМ: Когнитивна дисфункција у
системски еритематозни лупус: прошлост, садашњост и будућност.
Артхритис Рхеум 2008, 58:3286�3298.
99. Ланцастер Е, Мартинез-Хернандез Е, Далмау Ј: Енцефалитис и антитела на
синаптичке и неуронске ћелијске протеине. Неурологи 2011, 77:179�189.
100. Далмау Ј, Ланцастер Е, Мартинез-Хернандез Е, Росенфелд МР, Балице-Гордон
Р: Клиничко искуство и лабораторијска испитивања код пацијената са антиНМДАР
енцефалитис. Ланцет Неурол 2011, 10:63�74.
101. Лаи М, Хуијберс МГ, Ланцастер Е, Граус Ф, Баталлер Л, Балице-Гордон Р, Цовелл
ЈК, Далмау Ј: Истраживање ЛГИ1 као антигена у лимбичном енцефалитису
претходно приписиван калијумовим каналима: серија случајева. Ланцет Неурол
2010, 9:776�785.
102. Ланцастер Е, Хуијберс МГ, Бар В, Боронат А, Вонг А, Мартинез-Хернандез Е,
Вилсон Ц, Јацобс Д, Лаи М, Валкер РВ, Граус Ф, Баталлер Л, Илла И, Маркк С, Страусс
КА, Пелес Е, Сцхерер СС, Далмау Ј: Истраживање цаспр2, аутоантигена од
енцефалитис и неуромиотонија. Анн Неурол 2011, 69:303�311.
103. Ланцастер Е, Лаи М, Пенг Кс, Хугхес Е, Цонстантинесцу Р, Раизер Ј, Фриедман
Д, Скеен МБ, Грисолд В, Кимура А, Охта К, Иизука Т, Гузман М, Граус Ф,
Мосс СЈ, Балице-Гордон Р, Далмау Ј: Антитела на ГАБА (Б) рецептор у
лимбични енцефалитис са нападима: серије случајева и карактеризација
антиген. Ланцет Неурол 2010, 9:67�76.
104. Ланцастер Е, Мартинез-Хернандез Е, Титулаер МЈ, Боулос М, Веавер С, Антоине
ЈЦ, Лиеберс Е, Корнблум Ц, Биен ЦГ, Хоннорат Ј, Вонг С, Ксу Ј, извођач А,
Балице-Гордон Р, Далмау Ј: Антитела на метаботропни глутамат
рецептор 5 у Офелијском синдрому. Неурологи 2011, 77:1698�1701.105. Анцес БМ, Виталиани Р, Таилор РА, Лиебескинд ДС, Волосцхин А, Хоугхтон ДЈ,
Галетта СЛ, Дицхтер М, Алави А, Росенфелд МР, Далмау Ј: Третман реагује
лимбички енцефалитис идентификован неуропил антителима: МРИ и
ПЕТ корелације. Браин 2005, 128:1764�1777.
106. Тофарис ГК, Ирани СР, Цхееран БЈ, Бакер ИВ, Цадер ЗМ, Винцент А:
Хореа која реагује на имунотерапију као презентациона карактеристика ЛГИ1-
енцефалитис антитела. Неурологи 2012, 79:195�196.
107. Најјар С, Пеарлман Д, Најјар А, Гхиасиан В, Загзаг Д, Девински О:
Екстралимбични аутоимуни енцефалитис повезан са глутаминском киселином
антитела на декарбоксилазу: недовољно дијагностикован ентитет? Епилепсија Бехав
2011, 21:306�313.
108. Титулаер МЈ, МцЦрацкен Л, Габилондо И, Армангуе Т, Гласер Ц, Иизука Т, Хониг
ЛС, Бенселер СМ, Кавацхи И, Мартинез-Хернандез Е, Агуилар Е, Греса-Аррибас Н,
Риан-Флоранце Н, бујице А, Саиз А, Росенфелд МР, Балице-Гордон Р, Граус Ф,
Далмау Ј: Лечење и прогностички фактори за дугорочни исход у
пацијенти са енцефалитисом анти-НМДА рецептора: кохорта посматрања
студија. Ланцет Неурол 2013, 12:157�165.
109. Далмау Ј, Глеицхман АЈ, Хугхес ЕГ, Росси ЈЕ, Пенг Кс, Лаи М, Дессаин СК,
Росенфелд МР, Балице-Гордон Р, Линцх ДР: Анти-НМДА-рецептор
енцефалитис: серије случајева и анализа ефеката антитела.
Ланцет Неурол 2008, 7:1091�1098.
110. Граус Ф, Боронат А, Ксифро Кс, Боик М, Свигељ В, Гарциа А, Паломино А, Сабатер
Л, Алберцх Ј, Саиз А: Клинички профил анти-АМПА рецептора који се шири
енцефалитис. Неурологи 2010, 74:857�859.
111. Лаи М, Хугхес ЕГ, Пенг Кс, Зхоу Л, Глеицхман АЈ, Сху Х, Мата С, Кременс
Д, Виталиани Р, МД Гесцхвинд, Баталлер Л, Калб РГ, Давис Р, Граус Ф, Линцх ДР,
Балице-Гордон Р, Далмау Ј: Антитела на АМПА рецептор у лимбику
енцефалитис мења локацију синаптичких рецептора. Анн Неурол 2009, 65:424�434.
112. Најјар С, Пеарлман Д, Девински О, Најјар А, Надкарни С, Бутлер Т, Загзаг Д:
Неуропсихијатријски аутоимуни енцефалитис са негативним ВГКЦ-комплексом,
НМДАР и ГАД аутоантитела: извештај о случају и преглед литературе,
предстојећи. Цогн Бехав Неурол. у штампи.
113. Најјар С, Пеарлман Д, Загзаг Д, Девински О: Спонтано решавање
серонегативни аутоимуни лимбички енцефалитис. Цогн Бехав Неурол 2011,
24:99�105.
114. Габилондо И, Саиз А, Галан Л, Гонзалез В, Јадракуе Р, Сабатер Л, Санс А,
Семпере А, Вела А, Виљалобос Ф, Виалс М, Вилослада П, Граус Ф: Анализа
рецидиви код анти-НМДАР енцефалитиса. Неурологи 2011, 77:996�999.
115. Барри Х, Хардиман О, Хеали ДГ, Кеоган М, Моронеи Ј, Молнар ПП, Цоттер
ДР, Мурпхи КЦ: Енцефалитис рецептора против НМДА: важан
диференцијална дијагноза код психоза. Бр Ј Псицхиатри 2011, 199:508�509.
116. Дицкерсон Ф, Сталлингс Ц, Ваугхан Ц, Оригони А, Кхусхалани С, Иолкен Р:
Антитела на рецептор за глутамат у манији. Биполар Дисорд 2012,
14:547�553.
117. О'Лоугхлин К, Руге П, МцЦаулеи М: Енцефалитис и шизофренија: а
ствар речи. Бр Ј Псицхиатри 2012, 201: 74.
118. Парратт КЛ, Аллан М, Левис СЈ, Далмау Ј, Халмагии ГМ, Спиес ЈМ: Акутни
психијатријска болест код младе жене: необичан облик енцефалитиса.
Мед Ј Ауст 2009, 191:284�286.
119. Сузуки И, Курита Т, Сакураи К, Такеда И, Коиама Т: Приказ случаја против НМДА
рецепторски енцефалитис за који се сумња да је шизофренија. Сеисхин Схинкеигаку
Зассхи 2009, 111:1479�1484.
120. Тсутсуи К, Канбаиасхи Т, Танака К, Боку С, Ито В, Токунага Ј, Мори А,
Хисхикава И, Схимизу Т, Нисхино С: Откривено антитело на НМДА-рецептор
код енцефалитиса, шизофреније и нарколепсије са психотичним особинама.
БМЦ Псицхиатри 2012, 12:37.
121. Ван Путтен ВК, Хацхими-Идрисси С, Јансен А, Ван Горп В, Хуигхенс Л:
Неуобичајени узрок психотичног понашања код деветогодишње девојчице: случај
извештај. Извештај случаја Мед 2012, 2012: 358520.
122. Масдеу ЈЦ, Гонзалез-Пинто А, Матуте Ц, Руиз Де Азуа С, Паломино А, Де
Леон Ј, Берман КФ, Далмау Ј: ИгГ антитела против серума НР1
подјединица НМДА рецептора није откривена код шизофреније. Ам Ј
Психијатрија 2012, 169:1120�1121.
123. Кирван ЦА, Сведо СЕ, Курахара Д, Цуннингхам МВ: Стрептоцоццал мимицри
и ћелијска сигнализација посредована антителима у патогенези
Сиденхамова хореја. Аутоиммунити 2006, 39:21�29.
124. Сведо СЕ: Стрептококна инфекција, Тоуреттеов синдром и ОЦД: постоји
веза? Панде: Коњ или зебра? Неурологи 2010, 74:1397�1398.
125. Морер А, Лазаро Л, Сабатер Л, Массана Ј, Цастро Ј, Граус Ф: Антинеуронал
антитела у групи деце са опсесивно-компулзивним поремећајем
и Тоуреттеов синдром. Ј Псицхиатр Рес 2008, 42:64�68.
126. Павоне П, Бианцхини Р, Парано Е, Инцорпора Г, Риззо Р, Маззоне Л, Трифилетти РР:
Антитела против мозга у ПАНДАС-у насупрот некомпликованом стрептококу
инфекција. Педиатр Неурол 2004, 30:107�110.
127. Маина Г, Алберт У, Богетто Ф, Боргхесе Ц, Берро АЦ, Мутани Р, Росси Ф,
Виглиани МЦ: Анти-мождана антитела код одраслих пацијената са опсесивно-компулзивним
поремећај. Ј Аффецт Дисорд 2009, 116:192�200.
128. Бримберг Л, Бенхар И, Масцаро-Бланцо А, Алварез К, Лотан Д, Винтер Ц, Клеин Ј,
Мосес АЕ, Сомниер ФЕ, Лецкман ЈФ, Сведо СЕ, Цуннингхам МВ, Јоел Д:
Понашања, фармаколошке и имунолошке абнормалности након
излагање стрептококу: нови модел пацова Сиденхам цхореа и
повезани неуропсихијатријски поремећаји. Неуропсицхопхармацологи 2012,
37:2076�2087.
129. Дале РЦ, Цандлер ПМ, Цхурцх АЈ, Ваит Р, Поцоцк ЈМ, Гиованнони Г:
Неуронални површински гликолитички ензими су аутоантигенске мете у
пост-стрептококна аутоимуна болест ЦНС-а. Ј Неуроиммунол 2006,
172:187�197.
130. Ницхолсон ТР, Фердинандо С, Крисхнаиах РБ, Анхоури С, Леннок БР, МатаикЦолс
Д, Цлеаре А, Веале ДМ, Друммонд ЛМ, Финеберг НА, Цхурцх АЈ,
Гиованнони Г, Хеиман И: Распрострањеност антитела против базалних ганглија у
опсесивно-компулзивни поремећај за одрасле: студија пресека. Бр Ј Психијатрија
2012, 200:381�386.
131. Ву К, Ханна ГЛ, Росенберг ДР, Арнолд ПД: Улога глутамата
сигнализација у патогенези и лечење опсесивно-компулзивног
поремећај. Пхармацол Биоцхем Бехав 2012, 100:726�735.
132. Перлмуттер СЈ, Леитман СФ, Гарвеи МА, Хамбургер С, Фелдман Е, Леонард
ХЛ, Сведо СЕ: Терапијска размена плазме и интравенозна
имуноглобулин за опсесивно-компулзивни поремећај и тик поремећаје у
детињство. Ланцет 1999, 354:1153�1158.
133. Переира А Јр, Фурлан ФА: Астроцити и људска спознаја: моделирање
интеграција информација и модулација неуронске активности.
Прог Неуробиол 2010, 92:405�420.
134. Баррес БА: Мистерија и магија глије: поглед на њихове улоге у
здравље и болест. Неурон 2008, 60:430�440.
135. Веркхратски А, Парпура В, Родригуез ЈЈ: Где пребивају мисли:
физиологија неуронално-глијалне „дифузне неуронске мреже“. Браин Рес Рев 2011,
66:133�151.
136. Софрониев МВ: Молекуларна дисекција реактивне астроглиозе и глијалног ожиљка
формација. Трендс Неуросци 2009, 32:638�647.
137. Хамилтон НБ, Аттвелл Д: Да ли астроцити заиста егзоцитозирају неуротрансмитере?
Нат Рев Неуросци 2010, 11:227�238.
138. Рајковска Г: Постморталне студије поремећаја расположења указују на измењену
број неурона и глијалних ћелија. Биол Псицхиатри 2000, 48:766-777.
139. Цоупланд Њ, Огилвие ЦЈ, Хегадорен КМ, Серес П, Ханстоцк ЦЦ, Аллен ПС:
Смањен префронтални мио-инозитол код великог депресивног поремећаја.
Биол Псицхиатри 2005, 57:1526�1534.
140. Мигуел-Хидалго ЈЈ, Оверхолсер ЈЦ, Јурјус ГЈ, Мелтзер ХИ, Диетер Л, Коницк Л,
Стоцкмеиер ЦА, Рајковска Г: Васкуларна и екстраваскуларна имунореактивност
за међућелијски молекул адхезије 1 у орбитофронталној кори
субјекти са великом депресијом: промене зависне од старости. Ј утиче на дисорд
2011, 132:422�431.
141. Мигуел-Хидалго ЈЈ, Веи ЈР, Андрев М, Оверхолсер ЈЦ, Јурјус Г, Стоцкмеиер
ЦА, Рајковска Г: Патологија глије у префронталном кортексу у алкохолу
зависност са и без симптома депресије. Биол Псицхиатри 2002,
52:1121�1133.
142. Стоцкмеиер ЦА, Махајан ГЈ, Коницк ЛЦ, Оверхолсер ЈЦ, Јурјус ГЈ, Мелтзер ХИ,
Уилингс ХБ, Фриедман Л, Рајковска Г: Ћелијске промене у постмортему
хипокампус у великој депресији. Биол Псицхиатри 2004, 56:640-650.
143. Онг'р Д, Древетс ВЦ, Прице ЈЛ: Глијална редукција у субгенуалном префронталном
кортекса код поремећаја расположења. Проц Натл Ацад Сци УСА 1998, 95:13290�13295.
144. Гиттинс РА, Харрисон ПЈ: Морфометријска студија глије и неурона у
предња цингуласта кора у поремећају расположења. Ј Аффецт Дисорд 2011,
133:328�332.
145. Цоттер Д, Мацкаи Д, Беаслеи Ц, Кервин Р, Евералл И: Смањена глија густина
и запремину неурона код великог депресивног поремећаја и шизофреније у
предња цингуласта кора [сажетак]. Сцхизопхрениа Рес 2000, 41: 106.
146. Си Кс, Мигуел-Хидалго ЈЈ, Рајковска Г: ГФАП експресија је смањена у
дорзолатерални префронтални кортекс у депресији. У Друштву за неуронауку; 2003.
Планне за састанак за неуронауке: Њу Орлеанс; 2003.
147. Легутко Б, Махајан Г, Стоцкмеиер ЦА, Рајковска Г: Астроцити беле материје
смањују се у депресији. У Друштву за неуронауку. Састанак неуронауке
Планер: Васхингтон, ДЦ; 2011.148. Едгар Н, Сибилле Е: Претпостављена функционална улога олигодендроцита у
регулација расположења. Трансл Псицхиатри 2012, 2: е109.
149. Рајковска Г, Халарис А, Селемон ЛД: Редукције неурона и глија
густина карактерише дорсолатерални префронтални кортекс у биполарном
поремећај. Биол Псицхиатри 2001, 49:741-752.
150. Цоттер Д, Мацкаи Д, Цхана Г, Беаслеи Ц, Ландау С, Евералл ИП: Редуцед
величина неурона и густина глија ћелија у подручју 9 дорсолатерала
префронтални кортекс код испитаника са великим депресивним поремећајем. Цереб Цортек
2002, 12:386�394.
151. Старк АК, Уилингс ХБ, Санз-Аригита Е, Паккенберг Б: Глијски ћелијски губитак у
предња цингуласта кора, подрегија префронталне коре, у
субјекти са шизофренијом. Ам Ј Псицхиатри 2004, 161:882-888.
152. Конопаске ГТ, Дорпх-Петерсен КА, Свеет РА, Пиерри ЈН, Зханг В, Сампсон
АР, Левис ДА: Ефекат хроничне изложености антипсихотику на астроците и
бројеви олигодендроцита код мајмуна макака. Биол психијатрија 2008,
63:759�765.
153. Селемон ЛД, Лидов МС, Голдман-Ракић ПС: Повећана запремина и глија
густина у префронталном кортексу примата повезана са хроничном
изложеност антипсихотичним лековима. Биол Псицхиатри 1999, 46:161-172.
154. Стеинер Ј, Бернстеин ХГ, Биелау Х, Фаркас Н, Винтер Ј, Доброволни Х, Брисцх Р,
Гос Т, Маврин Ц, Миинт АМ, Богертс Б: С100Б-имунопозитивна глија је
повишен у параноику у поређењу са резидуалном шизофренијом: а
морфометријска студија. Ј Псицхиатр Рес 2008, 42:868�876.
155. Цартер ЦЈ: еИФ2Б и преживљавање олигодендроцита: где природа и негују
сусрећу се код биполарног поремећаја и шизофреније? Сцхизопхр Булл 2007,
33:1343�1353.
156. Хаиасхи И, Нихонматсу-Кикуцхи Н, Хисанага С, Иу КСЈ, Татебаиасхи И:
Неуропатолошке сличности и разлике између шизофреније
и биполарни поремећај: проточна цитометријска постмортална студија мозга.
ПЛоС Оне 2012, 7: е33019.
157. Уранова НА, Викхрева ОВ, Рахманова ВИ, Орловскаја ДД: Ултраструктурна
промене мијелинизованих влакана и олигодендроцита у префронталној
кортекс код шизофреније: постмортална морфометријска студија.
Сцхизопхр Рес Треатмент 2011, 2011: 325789.
158. Торрес-Платас СГ, Херцхер Ц, Даволи МА, Мауссион Г, Лабонте Б, Турецки
Г, Мецхавар Н: Астроцитна хипертрофија предњег цингулата бела
питање депресивних самоубистава. Неуропсицхопхармацологи 2011,
36:2650�2658.
159. Переира А Јр, Фурлан ФА: О улози синхроније за неурон-астроцит
интеракције и перцептивна свесна обрада. Ј Биол Пхис 2009,
35:465�480.
160. Кеттенманн Х, Ханисцх УК, Нода М, Веркхратски А: Пхисиологи оф
микроглија. Пхисиол Рев 2011, 91:461�553.
161. Тремблаи МЕ, Стевенс Б, Сиерра А, Ваке Х, Бессис А, Ниммерјахн А: Улога
микроглије у здравом мозгу. Ј Неуросци 2011, 31:16064�16069.
162. Каиндл АМ, Дегос В, Пеинеау С, Гоуадон Е, Цххор В, Лорон Г, Ле
Цхарпентиер Т, Јоссеранд Ј, Али Ц, Вивиен Д, Цоллингридге ГЛ, Ломбет А, Исса Л,
Рене Ф, Лоеффлер ЈП, Кавелаарс А, Вернеи Ц, Мантз Ј, Грессенс П: Активирање
микроглијски рецептори за Н-метил-Д-аспартат покрећу упалу и
смрт неуронских ћелија у мозгу у развоју и зрелом. Анн Неурол
2012, 72:536�549.
163. Сцхвартз М, Схакед И, Фисхер Ј, Мизрахи Т, Сцхори Х: Протецтиве
аутоимунитет против непријатеља унутар: борба против токсичности глутамата.
Трендс Неуросци 2003, 26:297�302.
164. Пацхецо Р, Галларт Т, Ллуис Ц, Францо Р: Улога глутамата на Т-ћелији
посредовани имунитет. Ј Неуроиммунол 2007, 185:9.
165. Најјар С, Пеарлман Д, Миллер ДЦ, Девински О: Повезана ватростална епилепсија
са микроглијалном активацијом. Неурологист 2011, 17:249�254.
166. Сцхвартз М, Бутовски О, Бруцк В, Ханисцх УК: Микроглијски фенотип: је
обавеза реверзибилна? Трендс Неуросци 2006, 29:68�74.
167. Ванг Ф, Ву Х, Ксу С, Гуо Кс, Ианг Ј, Схен Кс: Миграција макрофага
инхибиторни фактор активира циклооксигеназу 2-простагландин Е2 у култивисаном
микроглија кичме. Неуросци Рес 2011, 71:210�218.
168. Зханг КСИ, Ксиу МХ, Песма Ц, Цхенда Ц, Ву ГИ, Хаиле ЦН, Костен ТА, Костен
ТР: Повећани серум С100Б код лекова који никада нису узимали лекове
шизофрених пацијената. Ј Псицхиатр Рес 2010, 44:1236�1240.
169. Кавасаки И, Зханг Л, Цхенг ЈК, Ји РР: Цитокински механизми централног
сензибилизација: различита и преклапајућа улога интерлеукин-1бета,
интерлеукин-6 и фактор некрозе тумора-алфа у регулисању синаптичких и
активност неурона у површној кичменој мождини. Ј Неуросци 2008,
28:5189�5194.
170. Мллер Н, Сцхварз МЈ: Имунолошка основа глутаматергичних
поремећај у шизофренији: ка интегрисаном погледу. Ј Неурал
Трансм Суппл 2007, 72:269�280.
171. Хестад КА, Тонсетх С, ЦД Стоен, Уеланд Т, Аукруст П: Повишени нивои у плазми
фактора некрозе тумора алфа код пацијената са депресијом: нормализација
током електроконвулзивне терапије. Ј ЕЦТ 2003, 19:183-188.
172. Кубера М, Кенис Г, Босманс Е, Зиеба А, Дудек Д, Новак Г, Маес М:
Нивои интерлеукин-6, интерлеукин-10 и интерлеукин-1 рецептора у плазми
антагонист у депресији: поређење између акутног стања и после
ремисија. Пол Ј Пхармацол 2000, 52:237-241.
173. Миллер БЈ, Буцклеи П, Сеаболт В, Меллор А, Киркпатрицк Б: Мета-анализа
промене цитокина у шизофренији: клинички статус и антипсихотик
ефекти. Биол Псицхиатри 2011, 70:663�671.
174. Потвин С, Стип Е, Сепехри АА, Гендрон А, Бах Р, Коуасси Е: Запаљиво
промене цитокина у шизофренији: систематски квантитативни преглед.
Биол Псицхиатри 2008, 63:801�808.
175. Реале М, Патруно А, Де Лутиис МА, Песце М, Фелацо М, Ди Гианнантонио М, Ди
Ницола М, Грилли А: Дисрегулација производње хемо-цитокина у
шизофрени болесници наспрам здравих контрола. БМЦ Неуросци 2011, 12:13.
176. Флуитман СБ, Денис ДА, Хеијнен ЦЈ, Вестенберг ХГ: Гађење утиче на ТНФалпха,
Ниво ИЛ-6 и норадреналина код пацијената са опсесивно-компулзивним
поремећај. Псицхонеуроендоцринологи 2010, 35:906-911.
177. Конук Н, Текин ИО, Озтурк У, Атик Л, Атасои Н, Бектас С, Ердоган А: плазма
нивои фактора некрозе тумора-алфа и интерлеукин-6 код опсесивних
компулзивни поремећај. Медиаторс Инфламм 2007, 2007: 65704.
178. Монтелеоне П, Цатапано Ф, Фабраззо М, Торторелла А, Мај М: Смањено
нивои фактора туморске некрозе у крви у крви код пацијената са опсесивно-компулзивним
поремећај. Неуропсицхобиологи 1998, 37:182-185.
179. Мараззити Д, Преста С, Пфаннер Ц, Гемигнани А, Росси А, Сбрана С, Роццхи В,
Амброги Ф, Цассано ГБ: Имунолошке промене код одраслих опсесивно-компулзивних
поремећај. Биол Псицхиатри 1999, 46:810-814.
180. Заи Г, Арнолд ПД, Бурроугхс Е, Рицхтер МА, Кеннеди ЈЛ: Некроза тумора
ген фактор-алфа није повезан са опсесивно-компулзивним поремећајем.
Псицхиатр Генет 2006, 16:43.
181. Родргуез АД, Гонзелез ПА, Гарццха МЈ, де ла Роса А, Варгас М, Марреро Ф:
Циркадијске варијације у проинфламаторним концентрацијама цитокина у акутном
инфаркт миокарда. Рев Есп Цардиол 2003, 56:555�560.
182. Оливер ЈЦ, Бланд ЛА, Оеттингер ЦВ, Ардуино МЈ, МцАллистер СК, Агуеро СМ,
Фаверо МС: Кинетика цитокина у ин витро моделу пуне крви који следи
изазов ендотоксина. Лимпхокине Цитокине Рес 1993, 12:115-120.
183. Ле Т, Леунг Л, Царролл ВЛ, Сцхиблер КР: Регулација гена интерлеукин-10
израз: могући механизми који објашњавају његову регулацију и за
зреле разлике у његовом изражавању мононуклеарним ћелијама у крви.
Блоод 1997, 89:4112�4119.
184. Лее МЦ, Тинг КК, Адамс С, Брев БЈ, Цхунг Р, Гуиллемин ГЈ:
Карактеризација експресије НМДА рецептора код човека
астроцити. ПЛоС Оне 2010, 5: е14123.
185. Миинт АМ, Ким ИК, Веркерк Р, Сцхарпе С, Стеинбусцх Х, Леонард Б:
Пут кинуренина у великој депресији: докази о оштећењу
неуропротекција. Ј Аффецт Дисорд 2007, 98:143�151.
186. Санацора Г, Треццани Г, Пополи М: Ка глутаматној хипотези о
депресија: нова граница неуропсихопармакологије за
поремећаји расположења. Неуропхармацологи 2012, 62:63�77.
187. Салех А, Сцхроетер М, Јонкманнс Ц, Хартунг ХП, Моддер У, Јандер С: Ин
виво МРИ упале мозга код исхемијског можданог удара човека. Мозак 2004,
127:1670�1677.
188. Тиллеук С, Херманс Е: Неуроинфламација и регулација глија глутамата
усвајање код неуролошких поремећаја. Ј Неуросци Рес 2007, 85:2059�2070.
189. Хелмс ХЦ, Маделунг Р, Ваагепетерсен ХС, Ниелсен ЦУ, Бродин Б: Ин витро
докази за хипотезу о изливу глутамата из мозга: ендотел мозга
ћелије кокултоване са астроцитима приказују поларизовани мозак у крв
транспорт глутамата. 2012, 60:882�893.
190. Леонард БЕ: Концепт депресије као дисфункције имунолошког система
система. Цурр Иммунол Рев 2010, 6:205�212.
191. Лабрие В, Вонг АХ, Родер ЈЦ: Прилози Д-серин пута ка
шизофренија. Неуропхармацологи 2012, 62:1484�1503.
192. Грас Г, Самах Б, Хуберт А, Леоне Ц, Порцхераи Ф, Риманиол АЦ: ЕААТ
израз макрофага и микроглије: још увек више питања него
одговори. Амино киселине 2012, 42:221�229.
193. Ливингстоне ПД, Дицкинсон ЈА, Сринивасан Ј, Кев ЈН, Воннацотт С:
Преслушавање глутамат-допамин у префронталном кортексу пацова модулира се помоћу никотинских рецептора Алпха7 и потенцира помоћу ПНУ-120596. Ј Мол
Неуросци 2010, 40:172�176.194. Кондзиелла Д, Бреннер Е, Еијолфссон ЕМ, Сонневалд У: Како се глиалнеуронал
интеракције се уклапају у тренутне хипотезе неуротрансмитера
шизофренија? Неуроцхем Инт 2007, 50:291�301.
195. Штаб Ву, Переира ЕФ, Бруно ЈП, Пеллицциари Р, Албукуеркуе ЕКС, Сцхварцз Р: Тхе
антагонист никотинског рецептора алфа7 никоцинског рецептора астроцита кинуренска киселина
контролише ниво ванћелијског глутамата у префронталном кортексу. Ј Мол
Неуросци 2010, 40:204�210.
196. Стеинер Ј, Богертс Б, Сцхроетер МЛ, Бернстеин ХГ: С100Б протеин у
неуродегенеративни поремећаји. Цлин Цхем Лаб Мед 2011, 49:409�424.
197. Стеинер Ј, Маркуардт Н, Паулс И, Сцхилтз К, Рахмоуне Х, Бахн С, Богертс Б,
Сцхмидт РЕ, Јацобс Р: Хумане ЦД8 (+) Т ћелије и НК ћелије експресују и
луче С100Б након стимулације. Браин Бехав Иммун 2011, 25:1233�1241.
198. Сханмугам Н, Ким ИС, Лантинг Л, Натарајан Р: Регулација
експресија циклооксигеназе-2 у моноцитима лигацијом рецептора
за напредне крајње производе гликације. Ј Биол Цхем 2003, 278:34834�34844.
199. Ротхермундт М, Охрманн П, Абел С, Сиегмунд А, Педерсен А, Понатх Г,
Суслов Т, Петерс М, Каестнер Ф, Хеиндел В, Аролт В, Пфлеидерер Б: Глијална ћелија
активација у подгрупи пацијената са шизофренијом на коју указује
повећане концентрације С100Б у серуму и повишени мио-иноситол.
Прог Неуропсицхопхармацол Биол Псицхиатри 2007, 31:361-364.
200. Фалцоне Т, Фазио В, Лее Ц, Симон Б, Францо К, Марцхи Н, Јанигро Д: Серум
С100Б: потенцијални биомаркер за самоубиство код адолесцената? ПЛоС Оне
2010, 5: е11089.
201. Сцхроетер МЛ, Абдул-Кхалик Х, Кребс М, Диефенбацхер А, Бласиг ИЕ: Серум
маркери подржавају глија патологију специфичну за болест код велике депресије.
Ј Аффецт Дисорд 2008, 111:271�280.
202. Ротхермундт М, Ахн ЈН, Јоргенс С: С100Б у шизофренији: ажурирање.
Ген Пхисиол Биопхис 2009, 28 Спец Но Фоцус:Ф76�Ф81.
203. Сцхроетер МЛ, Абдул-Кхалик Х, Кребс М, Диефенбацхер А, Бласиг ИЕ: Неуронспецифиц
енолаза је непромењена, док је С100Б повишен у серуму
пацијенти са шизофренијом оригинално истраживање и мета-анализа.
Псицхиатри Рес 2009, 167:66.
204. Ротхермундт М, Мисслер У, Аролт В, Петерс М, Леадбеатер Ј, Виесманн М,
Рудолф С, Вандингер КП, Кирцхнер Х: Повећани нивои С100Б у крви у
немедицински и лечени шизофрени болесници су у корелацији са
негативна симптоматологија. Мол Псицхиатри 2001, 6:445-449.
205. Суцханкова П, Кланг Ј, Цаванна Ц, Холм Г, Нилссон С, Јонссон ЕГ, Екман А:
Да ли је релевантан полиморфизам Гли82Сер у РАГЕ гену
шизофренија и психотизам особина личности? Ј Неуросци психијатрије
2012, 37:122�128.
206. Сцапагнини Г, Давинелли С, Драго Ф, Де Лорензо А, Ориани Г: Антиоксиданти као
антидепресиви: чињеница или фикција? ЦНС Другс 2012, 26:477�490.
207. Нг Ф, Берк М, Деан О, Бусх АИ: Оксидативни стрес у психијатријским поремећајима:
база доказа и терапијске импликације. Инт Ј Неуропсицхопхармацол
2008, 11:851�876.
208. Салим С, Цхугх Г, Асгхар М: Упала у анксиозности. Адв Протеин Цхем
Струцт Биол 2012, 88:1�25.
209. Андерсон Г, Берк М, Додд С, Бецхтер К, Алтамура АЦ, Делл'оссо Б, Канба С,
Моњи А, Фатеми СХ, Буцклеи П, Дебнатх М, Дас УН, Меиер У, Мллер Н,
Канцханатаван Б, Маес М: Имуно-инфламаторно, оксидативно и нитрозативно
стрес и неуропрогресивни путеви у етиологији, току и лечењу
од шизофреније. Прог Неуропсицхопхармацол Биол Псицхиатри 2013, 42:1�42.
210. Цоугхлин ЈМ, Исхизука К, Кано СИ, Едвардс ЈА, Сеифуддин ФТ, Схимано МА,
Далеи ЕЛ, ет ал: Изражена редукција растворљиве супероксид дисмутазе-1
(СОД1) у цереброспиналној течности пацијената са недавним почетком
шизофренија. Мол Психијатрија 2012, 18:10�11.
211. Бомбаци М, Грифантини Р, Мора М, Регуззи В, Петрацца Р, Меони Е, Баллони С,
Зингаретти Ц, Фалуги Ф, Манетти АГ, Маргарит И, Муссер ЈМ, Цардона Ф, Орефици
Г, Гранди Г, Бенси Г: Профилирање низа протеина тичких серума пацијента открива а
широк опсег и појачани имуни одговор против групе А.
Антигени стрептококуса. ПЛоС Оне 2009, 4: е6332.
212. Валерио А, Цардиле А, Цоззи В, Брацале Р, Тедесцо Л, Писцонти А, Паломба Л,
Цантони О, Цлементи Е, Монцада С, Царруба МО, Нисоли Е: ТНФ-алфа
смањује експресију еНОС-а и биогенезу митохондрија у масти
и мишића гојазних глодара. Ј Цлин Инвест 2006, 116:2791�2798.
213. Отт М, Гогвадзе В, Оррениус С, Зхивотовски Б: Митохондрије, оксидативни
стрес и смрт ћелија. Апоптоза 2007, 12:913-922.
214. Шалев Х, Серлин И, Фридман А: Пробијање крвно-мождане баријере као капија
на психијатријски поремећај. Цардиовасц Псицхиатри Неурол 2009, 2009: 278531.
215. Абботт Њ, Роннбацк Л, Ханссон Е: Астроцитне-ендотелне интеракције на
крвно-мождана баријера. Нат Рев Неуросци 2006, 7:41.
216. Бецхтер К, Реибер Х, Херзог С, Фуцхс Д, Тумани Х, Макеинер ХГ:
Анализа цереброспиналне течности у афективном и шизофреном спектру
поремећаји: идентификација подгрупа са имунолошким одговорима и
дисфункција крвно-ликворне баријере. Ј Псицхиатр Рес 2010, 44:321�330.
217. Харрис ЛВ, Ваиланд М, Лан М, Риан М, Гигер Т, Лоцкстоне Х, Вуетхрицх И,
Миммацк М, Ванг Л, Коттер М, Цраддоцк Р, Бахн С: Тхе церебрал
микроваскулатура код шизофреније: студија микродисекције ласерским хватањем.
ПЛоС Оне 2008, 3: е3964.
218. Лин ЈЈ, Мула М, Херманн БП: Откривање неуропонашања
коморбидитети епилепсије током животног века. Ланцет 2012, 380:1180�1192.
219. Исингрини Е, Белзунг Ц, Фреслон ЈЛ, Мацхет МЦ, Цамус В: Ефекат флуоксетина на
ваорелаксација аортног азотног оксида у непредвидивој
модел хроничног благог стреса депресије код мишева. Псицхосом Мед 2012,
74:63�72.
220. Зханг КСИ, Зхоу ДФ, Цао ЛИ, Зханг ПИ, Ву ГИ, Схен ИЦ: Ефекат
лечење рисперидоном на супероксид дисмутази код шизофреније. Ј Цлин
Псицхопхармацол 2003, 23:128-131.
221. Лавоие КЛ, Пеллетиер Р, Арсенаулт А, Дупуис Ј, Бацон СЛ: Удружење између
клиничка депресија и функција ендотела мерено подлактицом
хиперемична реактивност. Псицхосом Мед 2010, 72:20�26.
222. Цхрапко В, Јурасз П, Радомски МВ, Арцхер СЛ, Невман СЦ, Бакер Г, Лара Н,
Ле Мелледо ЈМ: Промена смањених метаболита НО у плазми и
активност тромбоцита НО синтазе пароксетином код депресивних пацијената.
Неуропсицхопхармацологи 2006, 31:1286�1293.
223. Цхрапко ВЕ, Јурасз П, Радомски МВ, Лара Н, Арцхер СЛ, Ле Мелледо ЈМ:
Смањена активност синтетазе азот оксида тромбоцита и азот оксида плазме
метаболити код великог депресивног поремећаја. Биол Псицхиатри 2004, 56:129.
224. Стуехр ДЈ, Сантолини Ј, Ванг ЗК, Веи ЦЦ, Адак С: Ажурирање механизма
и каталитичка регулација у НО синтазама. Ј Биол Цхем 2004,
279:36167�36170.
225. Цхен В, Друхан Љ, Цхен ЦА, Хеманн Ц, Цхен ИР, Берка В, Тсаи АЛ, Звеиер
ЈЛ: Пероксинитрит изазива уништавање тетрахидробиоптерина и
хем у ендотелијској азот-оксид-синтази: прелазак из реверзибилног у
неповратна инхибиција ензима. Биоцхемистри 2010, 49:3129�3137.
226. Цхен ЦА, Ванг ТИ, Варадхарај С, Реиес ЛА, Хеманн Ц, Талукдер МА, Цхен
ИР, Друхан Љ, Звеиер ЈЛ: С-глутатионилација раздваја еНОС и
регулише његову ћелијску и васкуларну функцију. Натуре 2010, 468:1115�1118.
227. Сзабо Ц, Исцхиропоулос Х, Ради Р: Пероксинитрит: биохемија,
патофизиологија и развој терапије. Нат Рев Друг Дисцов
2007, 6:662�680.
228. Папакостас ГИ, Схелтон РЦ, Зајецка ЈМ, Етемад Б, Рицкелс К, Цлаин А, Баер Л,
Далтон ЕД, Саццо ГР, Сцхоенфелд Д, Пенцина М, Меиснер А, Боттиглиери Т,
Нелсон Е, Мисцхоулон Д, Алперт ЈЕ, Барбее ЈГ, Зисоок С, Фава М: Лметхилфолате
као додатна терапија за велику депресију резистентну на ССРИ:
резултати два насумична, двоструко слепа, паралелно-секвенцијална испитивања. Ам Ј
Психијатрија 2012, 169:1267�1274.
229. Антониадес Ц, Схиродариа Ц, Варрицк Н, Цаи С, де Боно Ј, Лее Ј, Леесон П,
Неубауер С, Ратнатунга Ц, Пиллаи Р, Рефсум Х, Цханнон КМ: 5-
метилтетрахидрофолат брзо побољшава функцију ендотела и
смањује производњу супероксида у људским судовима: ефекти на васкуларне
доступност тетрахидробиоптерина и синтетаза ендотелног азот-оксида
квачило. Тираж 2006, 114:1193�1201.
230. Масано Т, Кавасхима С, Тох Р, Сатоми-Кобаиасхи С, Схинохара М, Такаиа Т,
Сасаки Н, Такеда М, Тава Х, Иамасхита Т, Иокоиама М, Хирата К: благотворно
ефекти егзогеног тетрахидробиоптерина на преуређивање леве коморе
након инфаркта миокарда код пацова: могућа улога оксидативног стреса
узроковане неспојеном ендотелном синтазом азот-оксида. Цирц Ј 2008,
72:1512�1519.
231. Алп Њ, Цханнон КМ: Регулација ендотелне синтазе азот-оксида помоћу
тетрахидробиоптерин код васкуларних болести. Артериосцлер Тхромб Васц Биол 2004,
24:413�420.
232. Сзимански С, Асхтари М, Зито Ј, Дегрееф Г, Богертс Б, Лиеберман Ј:
Гадолиниум-ДТПА побољшани градијент ехо магнетне резонанце
прва епизода психозе и хроничних шизофрених болесника.
Псицхиатри Рес 1991, 40:203.
233. Бутлер Т, Веисхолтз Д, Исенберг Н, Хардинг Е, Епстеин Ј, Стерн Е, Силберсвеиг
Д: Неуроимагинг фронтално-лимбичке дисфункције код шизофреније и
психоза повезана са епилепсијом: ка конвергентној неуробиологији.
Епилепси Бехав 2012, 23:113�122.234. Бутлер Т, Маоз А, Валлабхајосула С, Моеллер Ј, Ицхисе М, Паресх К, Первез Ф,
Фриедман Д, Голдсмитх С, Најјар С, Осборне Ј, Солнес Л, Ванг Кс, Френцх Ј,
Тхесен Т, Девински О, Кузниецки Р, Стерн Е, Силберсвеиг Д: Имагинг
упала код пацијента са епилепсијом повезаном са антителима на
декарбоксилаза глутаминске киселине [сажетак]. Ин Абстрацтс оф Друштво за епилепсију Ам,
Том 2. Балтимор: Америчко друштво за епилепсију; 2011: 191.
235. ван Берцкел БН, Боссонг МГ, Боеллаард Р, Клоет Р, Сцхуитемакер А, Цасперс
Е, Лууртсема Г, Виндхорст АД, Цахн В, Ламмертсма АА, Кахн РС:
Активација микроглије у недавно насталој шизофренији: квантитативни (Р) -
[11Ц] ПК11195 студија позитронске емисионе томографије. Биол психијатрија 2008,
64:820�822.
236. Доордуин Ј, де Вриес ЕФ, Виллемсен АТ, де Гроот ЈЦ, Диерцкк РА, Клеин ХЦ:
Неуроинфламација код психозе повезане са шизофренијом: ПЕТ студија.
Ј Нуцл Мед 2009, 50:1801�1807.
237. Такано А, Аракава Р, Ито Х, Татено А, Такахасхи Х, Матсумото Р, Окубо И,
Сухара Т: Периферни бензодиазепински рецептори код пацијената са хроничним
шизофренија: ПЕТ студија са [11Ц] ДАА1106. Инт Ј
Неуропсицхопхармацол 2010, 13:943-950.
238. Мллер Н, Сцхварз МЈ, Дехнинг С, Доухе А, Церовецки А, Голдстеин-Муллер Б,
Спеллманн И, Хетзел Г, Маино К, Клеиндиенст Н, Мллер ХЈ, Аролт В, Риедел М:
Инхибитор циклооксигеназе-2 целекоксиб има терапеутске ефекте у
велика депресија: резултати двоструко слепог, рандомизираног, плацеба
контролисана, додатна пилот студија за ребоксетин. Мол Псицхиатри 2006,
11:680�684.
239. Акхондзадех С, Јафари С, Раиси Ф, Насехи АА, Гхореисхи А, Салехи Б, МохеббиРаса
С, Разнахан М, Камалипоур А: Клиничко испитивање помоћног целекоксиба
лечење код пацијената са великом депресијом: двоструко слепи и
плацебо контролисано испитивање. Депресс Анкиети 2009, 26:607�611.
240. Мендлевицз Ј, Кривин П, Освалд П, Соуери Д, Албони С, Брунелло Н:
Скраћени почетак деловања антидепресива у случају велике депресије
повећање ацетилсалицилне киселине: пилот отворена студија. Инт Цлин
Псицхопхармацол 2006, 21:227-231.
241. Ухер Р, Царвер С, Повер РА, Морс О, Маиер В, Риетсцхел М, Хаусер Ј,
Дерновсек МЗ, Хенигсберг Н, Соуери Д, Плацентино А, фармер А, МцГуффин П:
Нестероидни антиинфламаторни лекови и ефикасност антидепресива у
велики депресивни поремећај. Псицхол Мед 2012, 42:2027�2035.
242. Мллер Н, Риедел М, Сцхеппацх Ц, Брандстаттер Б, Сокуллу С, Крампе К,
Улмсцхнеидер М, Енгел РР, Моллер ХЈ, Сцхварз МЈ: Корисни антипсихотик
ефекти терапије додатком целекоксиба у поређењу са само рисперидоном у
шизофренија. Ам Ј Псицхиатри 2002, 159:1029�1034.
243. Мллер Н, Риедел М, Сцхварз МЈ, Енгел РР: Клинички ефекти ЦОКС-2
инхибитори когниције код шизофреније. Еур Арцх Псицхиатри Цлин Неуросци
2005, 255:149�151.
244. Мллер Н, Краусе Д, Дехнинг С, Мусил Р, Сцхеннацх-Волфф Р, Обермеиер М,
Моллер ХЈ, Клаусс В, Сцхварз МЈ, Риедел М: Лечење целекоксибом у раном добу
стадијум шизофреније: резултати насумичне, двоструко слепе, плацебо контролисане
испитивање повећања целекоксиба лечења амисулпридом.
Сцхизопхр Рес 2010, 121:118.
245. Саииах М, Боостани Х, Паксересхт С, Малаиери А: Прелиминарни насумични одабир
двоструко слепо клиничко испитивање о ефикасности целекоксиба као додатка у
лечење опсесивно-компулзивног поремећаја. Псицхиатри Рес 2011,
189:403�406.
246. Сублетте МЕ, Еллис СП, Геант АЛ, Манн ЈЈ: Мета-анализа ефеката
еикосапентаенојске киселине (ЕПА) у клиничким испитивањима код депресије. Ј Цлин
Психијатрија 2011, 72:1577�1584.
247. Блоцх МХ, Ханнестад Ј: Омега-3 масне киселине за лечење
депресија: систематски преглед и метаанализа. Мол Псицхиатри 2012,
17:1272�1282.
248. Келлер ВР, Кум ЛМ, Вехринг ХЈ, Коола ММ, Буцханан РВ, Келли ДЛ: А
преглед антиинфламаторних средстава за симптоме шизофреније.
Ј Псицхопхармацол.
249. Варнер-Сцхмидт ЈЛ, Вановер КЕ, Цхен ЕИ, Марсхалл ЈЈ, Греенгард П:
Антидепресивни ефекти селективних инхибитора поновног преузимања серотонина (ССРИ)
умањују се противупалним лековима код мишева и људи. Проц Натл
Ацад Сци УСА 2011, 108:9262�9267.
250. Галлагхер ПЈ, Цастро В, Фава М, Веилбург ЈБ, Мурпхи СН, Гаинер ВС, Цхурцхилл
СЕ, Кохане ИС, Иосифесцу ДВ, Смоллер ЈВ, Перлис РХ: Антидепресивни одговор
код пацијената са великом депресијом изложеним НСАИЛ: а
студија фармаковигиланце. Ам Ј Псицхиатри 2012, 169:1065�1072.
251. Схелтон РЦ: Да ли истовремена употреба НСАИЛ смањује ефикасност лека
антидепресиви? Ам Ј Псицхиатри 2012, 169:1012�1015.
252. Мартинез-Грас И, Перез-Ниевас БГ, Гарциа-Буено Б, Мадригал ЈЛ, АндресЕстебан
Е, Родригуез-Јименез Р, Хоеницка Ј, Паломо Т, Рубио Г, Леза ЈЦ:
Противупални простагландин 15д-ПГЈ2 и његов нуклеарни рецептор
ППАРгамма се смањује код шизофреније. Сцхизопхр Рес 2011,
128:15�22.
253. Гарциа-Буено Б, Перез-Ниевас БГ, Леза ЈЦ: Да ли постоји улога за нуклеарну
рецептор ППАРгамма код неуропсихијатријских болести? Инт Ј
Неуропсицхопхармацол 2010, 13:1411-1429.
254. Меиер У: Противупално сигнализирање код шизофреније. Браин Бехав
Иммун 2011, 25:1507�1518.
255. Рамер Р, Хеинеманн К, Меркорд Ј, Рохде Х, Саламон А, Линнебацхер М,
Хинз Б: ЦОКС-2 и ППАР-гама дају апоптозу изазвану канабидиолом
ћелија рака плућа код људи. Мол Цанцер Тхер 2013, 12:69�82.
256. Хенри ЦЈ, Хуанг И, Винне А, Ханке М, Химлер Ј, Баилеи МТ, Схеридан ЈФ,
Годбоут ЈП: Миноциклин умањује липополисахариде (ЛПС) индуковане
неуроинфламе, болесно понашање и анхедонија.
Ј Неуроинфламматион 2008, 5:15.
257. Саррис Ј, Мисцхоулон Д, Сцхвеитзер И: Омега-3 за биполарни поремећај: метаанализе
употребе у манији и биполарној депресији. Ј Цлин Псицхиатри 2012,
73:81�86.
258. Аммингер ГП, Сцхафер МР, Папагеоргиоу К, Клиер ЦМ, Цоттон СМ, Харриган
СМ, Мацкиннон А, МцГорри ПД, Бергер ГЕ: Дуголанчане омега-3 масне киселине
за индицирану превенцију психотичних поремећаја: рандомизирани, плацебо контролисани
суђење. Арцх Ген Псицхиатри 2010, 67:146�154.
259. Фусар-Поли П, Бергер Г: Интервенције еикосапентаенојске киселине у
шизофренија: мета-анализа рандомизираних, плацебо контролисаних студија.
Ј Цлин Псицхопхармацол 2012, 32:179�185.
260. Зорумски ЦФ, Паул СМ, Изуми И, Цовеи ДФ, Меннерицк С: Неуростероиди,
стрес и депресија: потенцијалне терапијске могућности.
Неуросци Биобехав Рев 2013, 37:109�122.
261. Ухде ТВ, Сингаредди Р: Биолошка истраживања у анксиозним поремећајима. У
Психијатрија као неуронаука. Уредили Јуан Јосе ЛИ, Волфганг Г, Марио М,
Норман С. Цхицхестер: Јохн Вилеи & Сонс, Лтд; 2002:237�286.
262. Гибсон СА, Корадо З, Схелтон РЦ: Оксидативни стрес и глутатион
одговор у ткивним културама особа са већом депресијом.
Ј Псицхиатр Рес 2012, 46:1326�1332.
263. Нери ФГ, Монкул ЕС, Хатцх ЈП, Фонсеца М, Зунта-Соарес ГБ, Фреи БН,
Бовден ЦЛ, Соарес ЈЦ: Целекоксиб као додатак у лечењу
депресивне или мешовите епизоде биполарног поремећаја: двоструко слепа,
рандомизована, плацебом контролисана студија. 2008, 23:87�94.
264. Левине Ј, Цхолестои А, Зиммерман Ј: Могући антидепресивни ефекат
миноциклин. 1996, 153: 582.
265. Левковитз И, Мендловицх С, Ривкес С, Брав И, Левковитцх-Вербин Х, Гал Г,
Фенниг С, Тревес И, Крон С: Двоструко слепа, насумична студија о
миноциклин за лечење негативних и когнитивних симптома у
шизохпренија у раној фази. Ј Цлин Псицхиатри 2010, 71:138�149.
266. Мииаока Т, Иасукава Р, Иасуда Х, Хаиасхида М, Инагаки Т, Хоригуцхи Ј:
Могући антипсихотички ефекат миноциклина код пацијената са
шизофренија. Прог Неуропсицхопхармацол Биол Псицхиатри 2007, 31:304-307.
267. Мииаока Ј, Иасукава Р, Иасуда Х, Хаиасхида М, Инагаки Т, Хоригуцхи Ј:
Миноциклин као додатна терапија за шизофренију: отворена ознака
студија. 2008, 31:287�292.
268. Родригуез ЦИ, Бендер Ј Јр, Марцус СМ, Снапе М, Ринн М, Симпсон ХБ:
Повећање фармакотерапије миноциклином у опсесивно-компулзивном
поремећај: отворено испитивање. 2010, 71:1247�1249.
doi:10.1186/1742-2094-10-43
Цитирајте овај чланак као: Најјар ет ал .: Неуроинфламматион анд псицхиатриц
болест. Јоурнал оф Неуроинфламматион 2013 10:43.
Затвори Хармоника
Информације овде о „Неуроинфламација и психијатријска болест" није намењен да замени однос један на један са квалификованим здравственим радником или лиценцираним лекаром и није медицински савет. Подстичемо вас да доносите одлуке о здравственој заштити на основу вашег истраживања и партнерства са квалификованим здравственим радником.
Информације о блогу и дискусије о обиму
Наш обим информација је ограничен на киропрактику, мускулоскелетну, физикалне лекове, веллнесс, доприносећи етиолошкој висцеросоматски поремећаји унутар клиничких презентација, повезане клиничке динамике соматовисцералног рефлекса, комплекса сублуксације, осетљивих здравствених проблема и/или чланака, тема и дискусија функционалне медицине.
Пружамо и представљамо клиничка сарадња са специјалистима из разних дисциплина. Сваки специјалиста се руководи својим професионалним обимом праксе и јурисдикцијом лиценцирања. Користимо функционалне здравствене и веллнесс протоколе за лечење и подршку нези повреда или поремећаја мишићно-скелетног система.
Наши видео снимци, постови, теме, теме и увиди покривају клиничка питања, проблеме и теме које се односе на и директно или индиректно подржавају наш клинички обим праксе.*
Наша канцеларија је разумно покушала да обезбеди цитате у прилог и идентификовала је релевантну истраживачку студију или студије које подржавају наше објаве. На захтев пружамо копије пратећих истраживачких студија доступне регулаторним одборима и јавности.
Разумемо да покривамо питања која захтевају додатно објашњење како то може помоћи у одређеном плану неге или протоколу лечења; зато, да бисте даље разговарали о горњој теми, слободно питајте Др Алек Јименез, ДЦ, или нас контактирајте 915-850-0900.
Овде смо да помогнемо вама и вашој породици.
Благослови
Др. Алек Јименез ДЦ, МСАЦП, РН*, ЦЦСТ, ИФМЦП*, ЦИФМ*, АТН*
e-маил: цоацх@елпасофунцтионалмедицине.цом
Лиценцирани као доктор киропрактике (ДЦ) у Тексас & Нови Мексико*
Тексас ДЦ лиценца бр. ТКСКСНУМКС, Нев Мекицо ДЦ Лиценца # НМ-ДЦ2182
Лиценцирана као медицинска сестра (РН*) in Флорида
Флорида лиценца РН лиценца # РНКСНУМКС (Контролни бр. 3558029)
Компактни статус: Вишедржавна лиценца: Овлашћени за праксу у КСНУМКС државе*
Др Алек Јименез ДЦ, МСАЦП, РН* ЦИФМ*, ИФМЦП*, АТН*, ЦЦСТ
Моја дигитална визит карта