Након трансекције периферног нерва горњих екстремитета и хируршке поправке, неки пацијенти враћају добру сензомоторну функцију док други не. Разумевање периферних и централних механизама који доприносе опоравку може олакшати развој нових терапијских интервенција. Пластичност након трансекције периферног нерва је демонстрирана у целој неурооси на животињским моделима повреде нерва. Међутим, промене у мозгу које се јављају након трансекције периферног нерва и хируршке поправке код људи нису испитане. Штавише, није окарактерисан степен у коме регенерација периферних нерава утиче на функционалне и структурне промене мозга. Стога смо питали да ли су функционалне промене праћене структурним променама сиве и/или беле материје и да ли се те промене односе на сензорни опоравак? Да бисмо одговорили на ова кључна питања, (и) смо проценили регенерацију периферних нерава; (ии) измерена функционална активација мозга магнетном резонанцом (сигнал зависан од нивоа кисеоника у крви; БОЛД) као одговор на вибротактилни стимулус; (иии) испитана пластичност структуре мозга сиве и беле материје; и (ив) корелиране мере сензорног опоравка са променама сиве материје код пацијената са трансекцијом периферног нерва и хируршким поправком. У поређењу са здравим контралезионим нервом сваког пацијента, пресечени нерви имају оштећену нервну проводљивост 1.5 година након трансекције и поправке, провођење са смањеном амплитудом и повећаном латенцијом. У поређењу са здравим контролама, пацијенти са трансекцијом периферног нерва и хируршким поправком имали су измењену сигналну активност зависну од нивоа кисеоника у крви у контралесионалним примарним и секундарним соматосензорним кортексима, иу скупу подручја мозга познатих као „мрежа позитивних задатака“. Поред тога, идентификовано је смањење сиве масе у неколико области мозга, укључујући контралезиону примарну и секундарну соматосензорну кору, у истим областима где су идентификована смањења сигнала зависна од нивоа кисеоника у крви. Штавише, стањивање сиве материје у пост-централном гирусу било је у негативној корелацији са мерама сензорног опоравка (механичка и детекција вибрација) показујући јасну везу између функције и структуре. Коначно, идентификовали смо смањену фракциону анизотропију беле материје у десној инсули у региону који је такође показао смањену сиву материју. Ови резултати пружају увид у пластичност мозга и односе структура-функција-понашање након повреде нерва и имају важне терапеутске импликације.
Кључне речи: дебљина коре; фМРИ; дифузионо тензорско снимање; пластичност; повреда периферног нерва
Скраћенице: БА=Бродманова област; БОЛД=зависно од нивоа кисеоника у крви; фМРИ=функционална магнетна резонанца;
ПНИр = трансекција периферног нерва и хируршка поправка; С1=примарни соматосензорни кортекс; С2=секундарни соматосензорни кортекс
Садржај
увод
Након трансекције периферног нерва горњег екстремитета и хируршке поправке (ПНИр), ?25% пацијената се није вратило на посао 1.5 година након операције (Јакует ет ал., 2001). Поред тога, ?57% пацијената са повредама нерава су старости између 16-35 година (МцАллистер ет ал., 1996); стога, дуг животни век инвалидности и економске потешкоће могу пратити трансекцију нерва горњих екстремитета. Разумевање централних и периферних последица повреде периферних нерава може олакшати развој нових терапијских стратегија и програма интервенције.
Није познато како мозак реагује на ПНИр код људи. Међутим, студије на животињама су утврдиле да пластичност унутар соматосензорног кортекса почиње одмах након трансекције периферног нерва, и да годину дана након потпуне трансекције нерва и хируршке поправке, кортикалне мапе садрже неуједначене, неконтинуиране приказе пресечених и суседних нерава (Валл ет ал. ., 1). Сматра се да механизми који олакшавају функционалну пластичност укључују тренутно разоткривање већ постојећих пројекција са суседних кортикалних и субкортикалних нивоа, и дугорочно ницање аксона на више нивоа неуроосе, укључујући примарни соматосензорни кортекс (С1986) (Флоренце и Каас , 1; Хицкмотт и Стеен, 1995).
Студије имиџинга људског мозга су потврдиле налазе са животињских модела са идентификацијом измењених функционалних мапа активације МРИ услед повреде кичмене мождине, ампутације, преноса са прста на палац и код пацијената са синдромом карпелног тунела (Лотзе ет ал., 2001; Мандуцх ет ал., 2002; Јуркиевицз ет ал., 2006; Нападов ет ал., 2006). Штавише, структуралне МРИ студије су недавно визуализовале промене сиве и беле материје након трауматских повреда иу различитим патолошким стањима, укључујући ампутацију удова и хронични бол (Апкариан ет ал., 2004; Драгански ет ал., 2006; Давис ет ал., 2008; Геха и сар., 2008; мај 2008). Сматра се да су промене сиве материје повезане са променама у величини ћелије, атрофијом и/или губитком неурона или глије, док су промене беле материје под утицајем дегенерације аксона и губитка мијелина (Беаулиеу, 2002; мај, 2008).
Моћан приступ разграничењу механизама патологије и пластичности је комбиновање функционалних и структурних техника снимања сиве и беле материје. Раније смо известили да су пацијенти са потпуним ПНИр горњих екстремитета задржали дубоке соматосензорне дефиците који перзистирају 41.5 година након операције (Таилор ет ал., 2008а). На основу ових налаза, закључили смо да ће ови пацијенти показати функционалне и структурне промене мозга у кључним соматосензорним подручјима мозга. Стога смо у овој студији претпоставили да би пацијенти са ПНИр имали: (и) смањене одговоре зависне од нивоа кисеоника у крви (БОЛД) на вибрационе стимулације пресечене нервне територије, у региону С1 који представља повређени горњи екстремитет и у секундарном соматосензорни кортекс (С2); (ии) одговарајуће смањење дебљине кортекса у овим регионима контралезија С1 и С2; (иии) корелација између промена у дебљини кортекса и психофизичких мера соматосензорне функције (прагови детекције вибрација и додира); и (ив) смањена фракциона анизотропија (мера интегритета беле материје) беле материје која се храни у/из ових соматосензорних кортикалних области.
Методе
Теме
Ангажовали смо 27 пацијената са потпуном трансекцијом средњег и/или улнарног нерва након чега је уследила хируршка поправка од стране пластичних хирурга повезаних са Програмом руку Универзитета у Торонту између јуна 2006. и маја 2008. Из ове веће групе, 14 пацијената без болова (три жене , 11 мушкараца; 34 ± 10 година) са потпуном трансекцијом десног средњег и/или улнарног нерва су укључени у студију [да би се избегле конфузије повезане са присуством бола и латералних пацијената са болом (н=6) и лезијама на левој страни (н=7) су искључени из ове анализе]. Сви пацијенти су подвргнути микрохируршкој поправци нерва најмање 1.5 године пре уписа у студију (време опоравка је варирало од 1.5 до 8 година). Поред тога, регрутовали смо 14 здравих контролних група које одговарају старости и полу (3 жене, 11 мушкараца; 34 ± 10 година). Сви субјекти су дали информирани писмени пристанак на процедуре које је одобрио Одбор за етику истраживања здравствене мреже Универзитета. Сви субјекти су били дешњаци (утврђено коришћењем Единбуршког инвентара рукотворства: Олдфиелд, 1971) и нису имали историју неуролошких повреда или хроничног бола (било пре или после трансекције нерва). Погледајте Табелу 1 за демографске детаље.
studija Дизајн
Сви субјекти су учествовали у сесији снимања која је укључивала: (и) функционалну магнетну резонанцу (фМРИ) као одговор на вибротактилне стимулусе примењене на десни кажипрст (унутар територије средњег нерва); (ии) анатомско скенирање у високој резолуцији целог мозга, добијено за регистрацију слике и за анализу кортикалне сиве материје; и (иии) два скенирања дифузионог тензора за процену интегритета беле материје. Пре снимања, субјекти су добили упутства о основном дизајну експеримента и подсетили их да остану што мирнији током трајања скенирања.
Субјекти су били слободни да се повуку из студије у било ком тренутку. Поред тога, извршена је сензорна и моторичка процена за све испитанике (Таилор ет ал., 2008а). Пошто су прагови детекције додира и вибрација у корелацији са дебљином кортекса, опис ових метода је укључен у наставку (друге психофизичке мере ће бити објављене на другом месту).
Праг вибрације
Прагови детекције вибрација су одређени коришћењем ручног био-тезиометра (Био-Медицал Инструмент Цомпани, САД). Уређај има сонду од 12 мм која је постављена на дисталну фалангу десног кажипрста (Д2). Прагови су одређивани методом граница: амплитуда (напон) се постепено повећавала све док испитаник није показао да перципира стимулус. Прагови вибрација су добијени три пута и израчуната је просечна вредност. Током тестирања прага вибрација, субјектима је наложено да затворе очи и ослоне задњи део шаке на јастук за подршку.
Праг механичке детекције
Прагови механичке детекције су одређени коришћењем стандардизованог сета вон Фреи филамената (ОптиХаир2 Марстоцк Нервтест, Немачка) који садржи 12 логаритамски распоређених калибрираних филамената који су испоручивали силе од 0.25 × 512 мН. Пречник контактне површине свих 12 филамената био је ~0.4 мм. Испитивања су спроведена са затвореним очима субјекта и рукама ослоњеним на мекани јастук. Сонде су примењене у растућој серији и од субјеката се захтевало да дају одговор сваки пут када осете да сонда додирне десни врх прста Д2. Овај процес је поновљен три пута. Сила за филамент која је откривена у најмање два од три испитивања пријављена је као праг механичке детекције тог субјекта.
Испитивање нервне проводљивости
Пацијенти су учествовали у билатералним студијама сензорне и моторне нервне проводљивости на клиници за електромиографију (ЕМГ) болнице у Торонту. За проводљивост моторног нерва, стимулативна електрода је постављена на зглоб и лакат (одвојено), а електрода за снимање је постављена преко абдуцтор поллицис бревис, за процену средњег нерва, или абдуцтор дигити миними за процену улнарног нерва. За испитивање сензорних нерва електрода за снимање је постављена на зглоб, а стимулациона електрода је постављена на цифре Д2, Д3 и Д5. Виши, искусни неуролог са ЕМГ клинике у Торонто Вестерн Хоспитал (Др Петер Асхби) прегледао је све клиничке процене да би утврдио који нерви су показали нормалне/ненормалне одговоре. Како је познато да мере амплитуде и латенције значајно варирају између испитаника (због фактора као што су густина инервације, дубина нерва и дебљина коже појединачног субјекта) (Кимура, 2001), нетрансектовани нерв сваког пацијента служиле као сопствена контрола за поређење са вредностима са пресечене стране. Код оних пацијената са одговорима нервне проводљивости који се могу детектовати, обављени су упарени т-тестови да би се проценила разлика у мерама латенције или амплитуде између трансектованих и контралезионих нетрансектованих нерава сваког пацијента.
Параметри слике
Подаци о снимању мозга су добијени коришћењем 3Т ГЕ МРИ система опремљеног осмоканалном фазном завојницом главе. Субјекти су стављени на леђа на сто за магнетну резонанцу, а глава сваког испитаника је била подстављена да би се смањило кретање. фМРИ подаци целог мозга су добијени коришћењем ехо планарног снимања (28 аксијалних пресека, видно поље (ФОВ) = 20 к 20 цм, 64 к 64 матрица, 3.125 к 3.125 к 4 мм воксели, време еха (ТЕ) = 30 мс, понављање време (ТР) = 2000 мс). Време скенирања је било 5 мин и 8 с (154 кадра). Током скенирања, на дисталну фалангу десног Д12 примењен је неболан вибротактилни стимулус од 2 Хз користећи балон дијафрагме покретане компримованим ваздухом (уређај произвођача Др Цхристо Пантев; ввв.биомаг.уни-муенстер.де). Стимули су испоручени у блоковима од 10 секунди испреплетених са 20 секунди одмора, за укупно 10 блокова стимулације и 10 блокова одмора. Првих 8 с (4 ТР) података добијених из сваке серије су одбачени да би се омогућила равнотежа фМРИ сигнала. Субјектима је наложено да држе затворене очи током скенирања и фокусирају се на стимулусе. Тродимензионално (3Д) анатомско скенирање целог мозга високе резолуције (124 сагитална пресека, 24 к 24 цм ФОВ, 256 к� 256 матрица, 1.5 к 0.94 к 0.94 мм воксели) је добијено Т1-пондерисаним градијентом 3Д споицхо секвенце (просек једног сигнала, угао преокрета = 20?, ТЕ ?5 мс). Поред тога, добијена су два скенирања дифузионог тензора (38 аксијалних пресека, ФОВ 24 к 24 цм, 128 к 128 матрица, 1.875 к 1.875 к 3 мм воксели) дуж 23 правца са б-вредношћу од 1000смм�2. Свака серија је такође садржала две запремине без дифузионог пондерисања.
фМРИ анализа
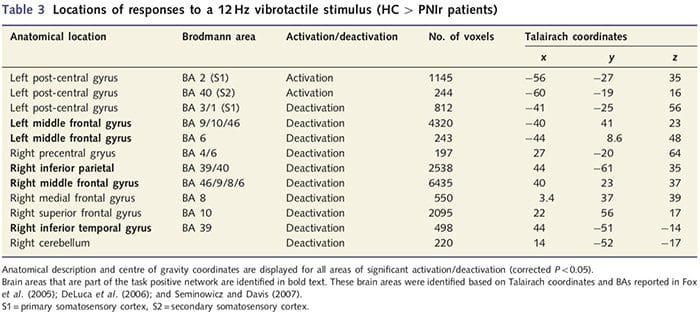
Подаци су анализирани коришћењем Браинвоиагер ККС в1.8 (Браин Инноватон, Мастрихт, Холандија). Претходна обрада је укључивала: корекцију 3Д покрета, корекцију времена скенирања пресека, уклањање линеарног тренда, високопропусно филтрирање (пет циклуса по трчењу) и просторно изглађивање са 6 мм пуне ширине на пола максимума (ФВХМ) Гаусово језгро. ФМРИ сетови података су интерполирани на вокселе 3 к 3 к 3 мм, регистровани на анатомској слици високе резолуције и нормализовани на стандардни Талаирацх простор (Талаирацх и Тоурноук, 1988). Воксели су пријављени као 1 к 1 к 1 мм. Подаци су анализирани коришћењем општег линеарног модела; модел је добијен конволвирањем бокцар функције временског тока тактилне стимулације са стандардном функцијом хемодинамског одговора. Да би се идентификовале групне разлике у обрасцима активације, извршена је анализа фиксних ефеката са контрастима: (и) здраве контроле: стимулација 4 одмор; (ии) ПНИр: стимулација 4 одмор; и (иии) здраве контроле 4 ПНИр. Активацијске мапе су постављене на исправљену вредност од П50.05 (изведене из некоригованих П50.0001 и 120 мм3 суседних воксела као што је претходно објављено: Таилор и Давис, 2009); ово је такође потврђено покретањем Монте Карло симулације са АлпхаСим апликацијом имплементираном у софтвер за анализу функционалне неуроимаге (АФНИ). Ова анализа је укључила само 11 пацијената који су имали трансекцију десног средњег нерва (н=9) или десног средњег и улнарног нерва (н = 2) (тј. три пацијента са чистом трансекцијом десног улнарног нерва нису укључена у ову анализу ).
Анализа дебљине корте
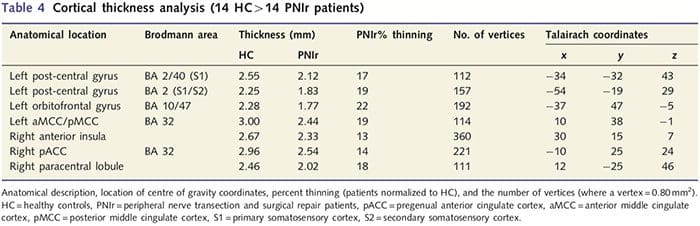
Анализа дебљине кортекса је извршена коришћењем Фреесурфера (хттп://сурфер.нмр.мгх.харвард.еду); методе су детаљно описане на другим местима (Дале ет ал., 1999; Фисцхл ет ал., 1999а, б; Фисцхл и Дале 2000). Укратко, Т1-пондерисани скупови анатомских података високе резолуције регистровани су у Талаирацх атласу (Талаирацх и Тоурноук, 1988). Затим је уследила нормализација интензитета, скидање лобање и одвајање хемисфера. Након тога, идентификоване су и сегментиране границе беле/сиве материје (назване бела површина) и сиве/ЦСФ (назване пијална површина). Удаљеност између беле и пијалне површине је затим израчуната у свакој тачки у свакој хемисфери мозга. Да би се идентификовале групне разлике између 14 пацијената и 14 контролних група које су одговарале узрасту/полу, извршена је општа анализа линеарног модела на свакој тачки мозга. Пошто је индивидуална кортикална топографија инхерентно хетерогена, пре статистичке анализе примењено је језгро просторног изравнавања од 5 мм ФВХМ. Подаци се приказују на исправљеном П50.05 (изведено из некоригованог П50.0075 и 102 суседна врха); ово је израчунато покретањем Монте Карло симулације са АлпхаСим-ом. Тем представља тачку на дводимензионалном листу, а у овој студији растојање између два врха је 0.80 мм2.
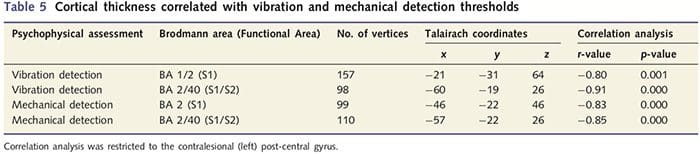
Пошто су пацијенти испољили значајне дефиците соматосензорне функције унутар пресечене нервне територије, претпоставили смо да ће мере соматосензорне функције (детекција вибрација и додира) корелирати са дебљином кортекса у контралезионом пост-централном гирусу (примарни и секундарни соматосензорни кортекс). Због тога смо извршили корелационе анализе у групи пацијената између: (и) дебљине кортекса и прага детекције вибрација; и (ии) дебљина кортекса и прагови детекције додира. Један пацијент није завршио психофизичку процену; стога је ова анализа обухватила 13 пацијената са ПНИр. Поред тога, да би се утврдило да ли постоји веза између дебљине кортекса и времена опоравка, такође је урађена корелација између ове две мере. Ове корелационе анализе су ограничене на контралесионални пост-централни гирус укључивањем маске (преузете из Фреесурферовог уграђеног атласа) у општи линеарни модел. Изведена је Монте Карло симулација која је била ограничена на број врхова унутар контралезионог пост-централног гируса; слике се приказују са исправљеним П50.05 (изведеним из некоригованог П50.0075 и 68 суседних врхова).
Анализа дифузионог тензора слике
Обрада слике дифузионог тензора обављена је са ДТиСтудио (ввв.МриСтудио.орг) и ФСЛв.4.0 (ввв.фмриб.ок.ац.ук/фсл/). Слике су прво поравнате помоћу алата за аутоматску регистрацију слика имплементираног у ДТиСтудио, користећи прву Б0 слику у првој серији добијену као шаблон. Овај процес исправља кретање субјекта и изобличење вртложне струје. Све слике су затим визуелно прегледане да би се проценио квалитет слике и поравнање одвојених серија дифузионог тензора. Ако је откривен артефакт, исечак је уклоњен пре израчунавања просека два одвојена циклуса снимања дифузионог тензора. Појединачне ФА карте су израчунате коришћењем алата ДТИФИТ имплементираног у ФСЛ. Статистичка анализа на основу воксела је извршена да би се идентификовале групне разлике у средњој фракционој анизотропији користећи просторну статистику засновану на тракту; за потпуни опис ових метода видети Смитх ет ал. (2006). Укратко, слике су нелинеарно регистроване на циљну слику (МНИ152), средња слика је затим креирана из свих скупова података и ова слика је накнадно истањена да представља све тракте који су заједнички за све субјекте. Највеће вредности фракционе анизотропије сваког субјекта су затим пројектоване на скелет тражењем беле материје окомито на сваку тачку на скелету беле материје. Затим је извршена статистичка анализа воксела целог мозга између група (14ПНИр и 14 здравих контрола) и слике су кориговане целог мозга на П50.05. Поред тога, обављена је анализа региона од интереса у белој материји трактати поред контралатералног С1, таламуса и билатералне предње и задње инсуле. Ови региони су изабрани јер су претходно били укључени у аспекте соматосензације и зато што одговарају регионима који су идентификовани у фМРИ и групним анализама кортикалне анализе дебљине (ЦТА). Региони од интереса су нацртани на скелету беле материје на следећи начин: (и) Контралатерални С1 регион од интереса настао је медијално на споју између скелета беле материје корона-радиата и дела скелета који се храни у пост-централни гирус; завршавајући на крају тракта унутар датог пресека.
У правцу з, област интересовања се простирала од з=49 до 57; тракти беле материје који снабдевају регион руке. (ии) Контралатерални регион таламуса од интереса био је ограничен на трагове беле материје који окружују задња и медијална језгра таламуса (језгра укључена у соматосензорну функцију), протежући се од з = �1 до 4. (иии) Острвни региони од интереса су нацртани билатерално унутар бела материја поред предње и задње инсуле на основу критеријума које је претходно објавила наша лабораторија (Таилор ет ал., 2008б). Регион интересовања се проширио од з = 2 до 8. Вредности фракционе анизотропије су екстраховане из сваког од ових региона од интереса и извршена је мултиваријантна анализа варијансе (МАНОВА) коришћењем Статистичког пакета за друштвене науке в13.0 (СПСС Инц, Чикаго), који је укључивао вредности фракционе анизотропије за свих шест региона од интереса.
Резултати
Табела 1 даје демографске детаље за учеснике студије. Свих 14 пацијената је претрпело потпуну трансекцију десног средњег и/или улнарног нерва након чега је уследила микрохируршка поправка најмање 1.5 године пре уписа у студију. Време од операције до тестирања кретало се од 1.5 до 8 година са средњом (?СД) од 4.8 ? 3 године. Пацијенти и контролне групе нису (34 ± 10 година обе групе; т = 0.04; П = 0.97).
Психофизика
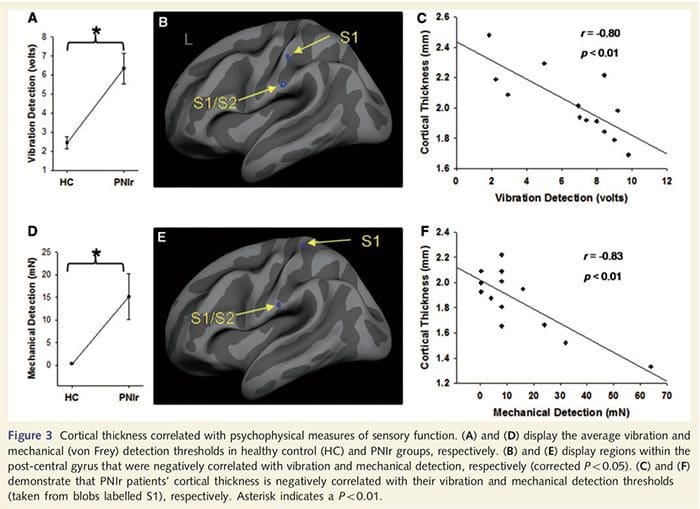
Прагови вибрације су израчунати на основу сва три мерења пошто једносмерна анализа варијансе поновљених мерења (АНОВА) није показала значајне разлике између три испитивања [Ф (25, 1)=0.227, П=0.64]. Прагови вибрације и механичке детекције били су значајно смањени код пацијената са ПНИр у поређењу са здравим контролама (вибрације: т = 4.77, П50.001, слика 3А; механичка: т=3.10, П=0.005, слика 3Д).
Испитивање нервне проводљивости
Мере амплитуде и латенције добијене од контралезионих нерава сваког пацијента класификоване су као нормалне од стране искусних неуролога у ЕМГ клиници у Торонто Вестерн Хоспитал. Девет од 14 пацијената је завршило тестирање нервне проводљивости. Табела 2 приказује просечне податке о повећању/смањењу латенције и амплитуде за сензорну нервну проводљивост од ручног зглоба до абдуцтор поллицис бревис (медијана) или абдуцтор дигити миними (улнарне) мишиће и за сензорну проводљивост од ручног зглоба до Д2 (медијана) и Д5 ( улнар) у поређењу са сваким пацијентом неповређени контралезиони нерв. Од девет пацијената, седам пацијената је имало трансекције које су укључивале средњи нерв. Од ових седам, један пацијент није имао одговор који се може детектовати током моторичког тестирања, а други пацијент није имао одговор током сензорног тестирања.
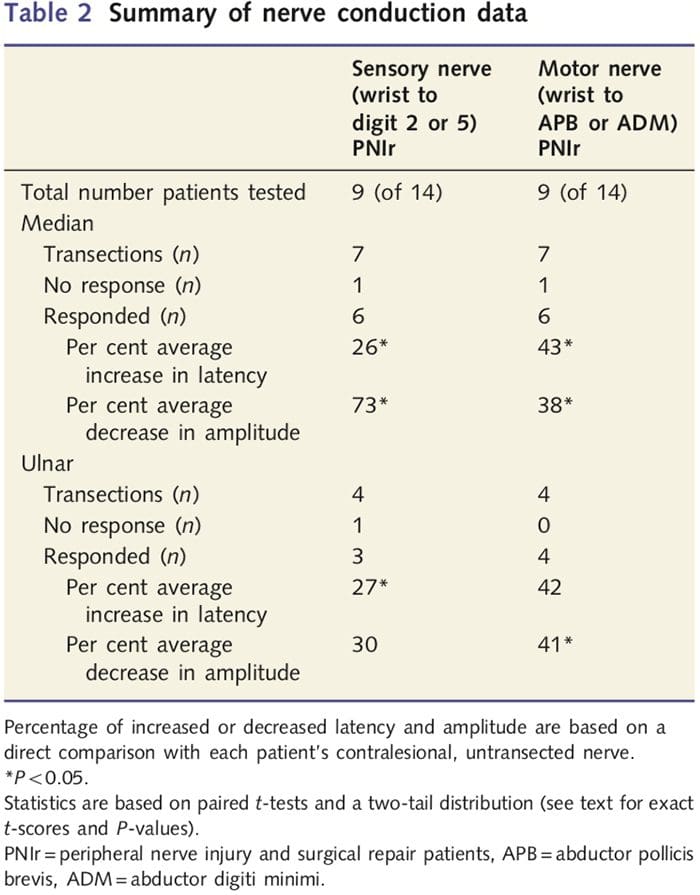 Код шест пацијената са одговорима који се могу детектовати, латенције моторне проводљивости су повећане за 43% (т=6.2; П=0.002), а амплитуде су смањене за 38% (т=�2.6; П=0.045) када је пресечени нерв сваког пацијента био у поређењу са њиховом неповређеном страном. Сензорна проводљивост у средњим нервима је такође открила повећање латенције од 26% (т=3.9; П=0.011) и смањење амплитуде за 73% (т=�8.0; П=0.000) у поређењу са нормалним контралезионим нервима. Код четири пацијента са трансекцијом улнарног нерва, један пацијент није имао уочљив одговор током тестирања сензорних нерава. Код оних пацијената са одговорима, моторне латенције улнарног нерва нису биле значајно повишене (т = 2.8; П = 0.070); међутим, амплитуде су биле значајне
Код шест пацијената са одговорима који се могу детектовати, латенције моторне проводљивости су повећане за 43% (т=6.2; П=0.002), а амплитуде су смањене за 38% (т=�2.6; П=0.045) када је пресечени нерв сваког пацијента био у поређењу са њиховом неповређеном страном. Сензорна проводљивост у средњим нервима је такође открила повећање латенције од 26% (т=3.9; П=0.011) и смањење амплитуде за 73% (т=�8.0; П=0.000) у поређењу са нормалним контралезионим нервима. Код четири пацијента са трансекцијом улнарног нерва, један пацијент није имао уочљив одговор током тестирања сензорних нерава. Код оних пацијената са одговорима, моторне латенције улнарног нерва нису биле значајно повишене (т = 2.8; П = 0.070); међутим, амплитуде су биле значајне
смањен за 41% (т = �5.9; П = 0.010). Сензорно тестирање улнарног нерва показало је повећање латенције од 27% (т = 4.3; П = 0.049), али без значајног повећања амплитуде (т = 3.5; П = 0.072).
Функционална пластичност у примарном соматосензорном кортексу
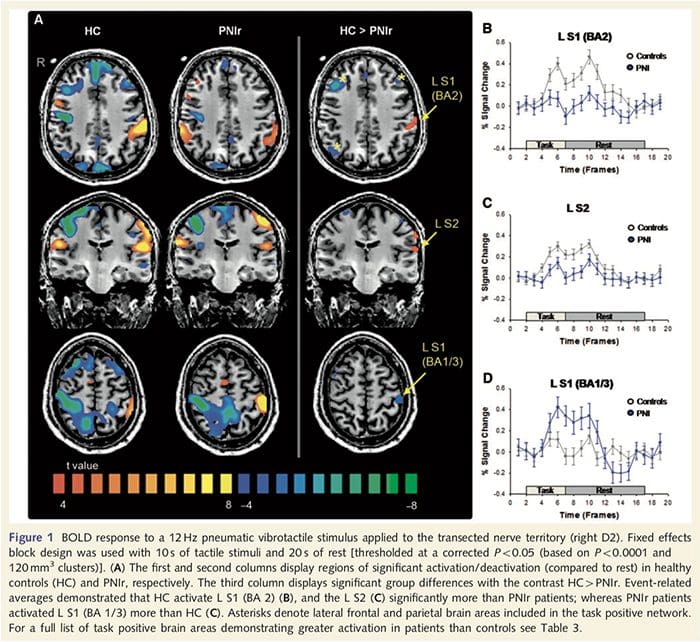
Функционалне МРИ мапе су израчунате од 11 пацијената са ПНИр са трансекцијом десног средњег нерва (пацијенти са трансекцијом улнарног нерва искључени су из ове анализе) и 11 здравих контрола по старости и полу. Са слике 1А, јасно је да пацијенти са ПНИр имају значајно мању активацију, у поређењу са здравим контролама, у региону С1 који одговара Бродмановој области 2 (БА2) (Талаирацх и Тоурноук, 1988) и С2 (погледајте табелу 3 за детаље) . Просечни одговори везани за догађаје из ових региона од интереса истичу ослабљени БОЛД одговор у левом БА2 и левом С2 пацијената (слике 1Б и Ц, респективно). Занимљиво је да је вибротактилна стимулација код пацијената активирала супериорнији део пост-централног гируса (вероватно БА1/3) (Талаирацх и Тоурноук, 1988) (Слика 1А и Табела 3). Просек везан за догађаје (слика 1Д) показује да су здраве контроле имале минималну активацију у овом региону. Штавише, пацијенти су имали значајно већу активацију у регионима мозга који су заједнички познати као мрежа позитивних задатака (звездице на слици 1). Погледајте табелу 3 за комплетну листу активираних подручја мозга позитивних на задатак. Ова мрежа укључује латерални префронтални, латерални паријетални, премоторни и доњи темпорални кортекс (табела 3): подручја мозга која се активирају током обављања задатка који захтева пажњу и потиснута или неактивна током одмора или задатака који нису когнитивно или пажњи изазовни (Фок ет. ал., 2005; ДеЛуца ет ал., 2006; Семиновицз и Давис 2007).
Смањена сива материја у примарном соматосензорном кортексу у корелацији са сензорним опоравком
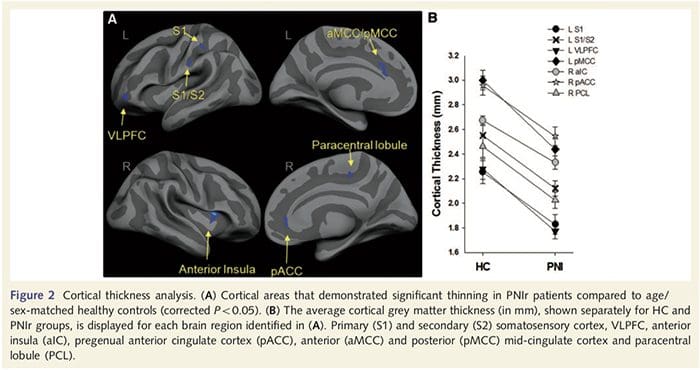
Анализа дебљине кортекса код свих 14 пацијената и 14 здравих контролних група које су одговарале узрасту/полу открила је неколико локуса значајног стањивања кортекса у ПНИр групи (Слика 2 и Табела 4). Конкретно, пацијенти су имали смањење дебљине кортекса од 13% - 22% у левом (контралезијском) С1, С2, прегенуалном предњем цингулатном гирусу, вентролатералном префронталном кортексу и десној предњој инсули, предњем/задњем средњем цингулатном гирусу и парацентралном лобулу. Занимљиво је да се локације стањивања сиве материје унутар пост-централног гируса поклапају са регионима смањеног БОЛД-а након вибротактилне стимулације (Табела 4). Пошто смо имали претходно знање о сензорним дефицитима пацијената и времену опоравка (тј. времену од микрохируршке поправке), затим смо питали да ли је дебљина кортекса у пост-централном гирусу у корелацији са њиховим сензорним механичким прагом и прагом детекције вибрација, или са њиховим време опоравка. Ове анализе су откриле негативну корелацију између дебљине кортекса и прагова детекције вибрација у региону који обухвата БА1/2 и С2 (П50.001, р=?0.80 и ?0.91, за БА1/2 и С2, респективно; слика 3 и табела 5 ). Поред тога, прагови механичке детекције су такође били у негативној корелацији са дебљином кортекса у нешто супериорнијем БА2 региону и истом С2 региону (П50.001, р = ?0.83 и ?0.85, за БА2 и С2, респективно; слика 3 и табела 5). Међутим, нисмо идентификовали значајну везу између времена опоравка и дебљине кортекса. Стога је у пост-централном гирусу кортикално стањивање било повезано са озбиљнијим сензорним дефицитима. Међутим, нисмо идентификовали значајну везу између времена опоравка и дебљине кортекса. Опет, постојала је кореспонденција између стањивања кортекса у областима које су у негативној корелацији са вибрационим стимулансима и регионима који показују групне фМРИ и ЦТА абнормалности.
Абнормалности беле материје након трансекције нерва
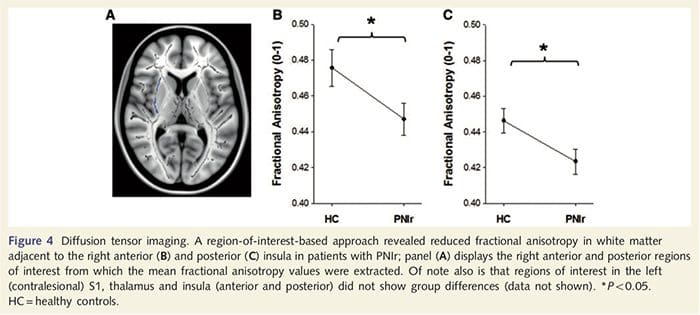
Да бисмо проценили интегритет беле материје, користили смо приступ региона од интереса да бисмо испитали разлике група беле материје на основу априорних хипотеза. Региони од интереса били су ограничени на тракте беле материје који окружују и који се хране у контралесионални С1 и таламус. Поред тога, такође смо нацртали регионе од интереса у белој материји поред леве и десне, предње и задње инсуле. Инсула је изабрана јер је укључена у соматосензорну обраду и зато што смо идентификовали смањену сиву материју у десном предњем инсулару са ЦТА. Овај приступ области од интереса је открио да пацијенти имају значајно смањене вредности фракционе анизотропије беле материје (МАНОВА укључујући свих шест региона од интереса) поред десне предње стране [Ф (1, 26) = 4.39, П = 0.046; Слика 4А] и задња инсула [Ф (1, 26) = 5.55, П = 0.026; Слика 4Б], али није било групних разлика у белој материји поред леве инсуле (лева предња инсула: П = 0.51; лева задња инсула: П=0.26), таламус (П=0.46) или С1 (П=0.46 ).
 Дискусија
Дискусија
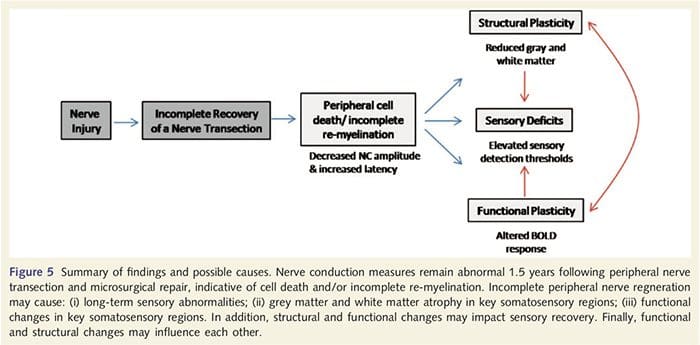
Овде смо по први пут показали да постоји функционална пластичност и структурне абнормалности и сиве и беле материје у неколико кортикалних области након трансекције периферног нерва горњих екстремитета и хируршке поправке. Ова пластичност може настати услед непотпуне регенерације периферних нерва (смрт периферних ћелија и/или непотпуна ремијелинизација), пошто су мере нервне проводљивости код ових пацијената показале озбиљне абнормалности. Поред тога, наши подаци показују да смањени вибротактилно изазвани фМРИ одговори у пост-централном гирусу одговарају стањивању сиве материје у групи пацијената. Ови резултати сугеришу да смањени БОЛД одговори могу бити олакшани смањењем кортикалне сиве материје и/или смањењем аферентног улаза у пост-централни гирус. Поред тога, дебљина кортекса унутар ових истих делова пост-централног гируса негативно је корелирала са мерама понашања соматосензорне функције. То јест, повећани соматосензорни дефицити су били у корелацији са тањим кортексом; оба могу бити повезана са аферентним уносом. Узети заједно, наши подаци сугеришу да непотпуна регенерација периферних нерава доприноси соматосензорним оштећењима, атрофији сиве материје кортекса и смањеној активацији фМРИ (видети Слику 5 за резиме ових налаза).
Добро је познато да се кортикална пластичност након трансекције периферног нерва и хируршке поправке може појавити у целом ЦНС-у код примата који нису људи (Каас, 1991). Сматра се да је ова пластичност последица демаскирања претходно тихих синапси или аксоналног избијања на деаферентисану територију (Валл ет ал., 1986; Флоренце и Каас, 1995). У моделу примата, годину дана након трансекције нерва и хируршке поправке, денервирани кортекс се карактерише некомплетним и неуређеним приказима регенерисаних и суседних (неоштећених) нерава. Ова неуједначена репрезентација се приписује непотпуној периферној регенерацији која резултира делимичним опоравком денервираног кортикалног простора (Каас, 1). Да бисмо проценили обим периферне регенерације у нашој популацији пацијената, урадили смо студије проводљивости сензорних и моторних нерава преко пресеченог подручја. Наши резултати нервне проводљивости показују да пацијенти са ПНИр имају значајно смањену амплитуду и повећану латенцију у сензорним и моторним нервима у поређењу са сопственом нетрансектираном страном. Смањена амплитуда у комбинацији са повећаном латенцијом указује на губитак периферних влакана (тј. ћелијска смрт) и/или абнормалну или непотпуну ремијелинацију након трансекције (Кимура, 1991). Поред тога, добро је утврђено да између 1984% и 20% неурона ганглија дорзалног корена умире након трансекције нерва (Лисс ет ал., 50). Према томе, смрт аферентне ћелије и непотпуна регенерација могу довести до смањеног аферентног уноса у кортекс, што може објаснити текући сензорни дефицит и смањен БОЛД одговор у БА1996 и С2. Штавише, овај смањени аферентни унос би такође могао да објасни стањивање коре које смо приметили у истим регионима кортекса. Показало се да сензорна депривација узрокује транс-неуронску дегенерацију у неколико региона ЦНС-а, укључујући дорзални рог који прати пресек ишијадичног нерва (Книихар-Цсиллик ет ал., 2), и може укључити неуроне другог и трећег реда (Повелл и Ерулкар, 1989). Транснеуронску дегенерацију карактерише скупљање ћелија и сматра се да је повезана са смањеним, или непостојећим, аферентним уносом (Книихар-Цсиллик ет ал., 1962). Дакле, губитак кортикалне сиве материје (или атрофија) такође може бити директно повезан са смањеним аферентним уносом.
 Такође смо показали повећану активацију у пост-централном гирусу у региону који одговара БА1/3 (Талаирацх и Тоурноук, 1988). Електрофизиолошке, анатомске и неуроимаџинг студије су утврдиле да су за већину кожних механорецептивних аферената прве кортикалне дестинације БА1 и БА3б. Свака од ових цитоархитектонских подручја мозга поседује соматотопску телесну мапу са малим рецептивним пољима. Поред тога, ове области реагују на многе карактеристике тактилних информација, као што су текстура и храпавост, брзина и закривљеност стимулуса (Бодегард ет ал., 2001). фМРИ студије су показале да је активност унутар соматосензорног кортекса под утицајем пажње тако да су фМРИ одговори на тактилне стимулусе у С1 повећани када субјекти присуствују тактилном стимулусу, али су ослабљени када су субјекти ометени (Артхурс ет ал., 2004; Порро ет ал., 2004). Штавише, наши пацијенти су више активирали мрежу подручја мозга позната као мрежа позитивних задатака (ДеЛуца ет ал., 2006) него здраве контроле. Ове области мозга се активирају током процеса који захтевају пажњу (Фок ет ал., 2005; Семиновицз и Давис, 2007). Заједно, ови налази имплицирају да пацијенти морају више да обраћају пажњу на стимулус него на контролу због њиховог ослабљеног сензорног уноса. Ова повећана пажња може такође објаснити повећану активацију у БА1/3б. Наравно, повећана активација у БА1/3б такође може одражавати пластичност која није повезана са оптерећењем пажње.
Такође смо показали повећану активацију у пост-централном гирусу у региону који одговара БА1/3 (Талаирацх и Тоурноук, 1988). Електрофизиолошке, анатомске и неуроимаџинг студије су утврдиле да су за већину кожних механорецептивних аферената прве кортикалне дестинације БА1 и БА3б. Свака од ових цитоархитектонских подручја мозга поседује соматотопску телесну мапу са малим рецептивним пољима. Поред тога, ове области реагују на многе карактеристике тактилних информација, као што су текстура и храпавост, брзина и закривљеност стимулуса (Бодегард ет ал., 2001). фМРИ студије су показале да је активност унутар соматосензорног кортекса под утицајем пажње тако да су фМРИ одговори на тактилне стимулусе у С1 повећани када субјекти присуствују тактилном стимулусу, али су ослабљени када су субјекти ометени (Артхурс ет ал., 2004; Порро ет ал., 2004). Штавише, наши пацијенти су више активирали мрежу подручја мозга позната као мрежа позитивних задатака (ДеЛуца ет ал., 2006) него здраве контроле. Ове области мозга се активирају током процеса који захтевају пажњу (Фок ет ал., 2005; Семиновицз и Давис, 2007). Заједно, ови налази имплицирају да пацијенти морају више да обраћају пажњу на стимулус него на контролу због њиховог ослабљеног сензорног уноса. Ова повећана пажња може такође објаснити повећану активацију у БА1/3б. Наравно, повећана активација у БА1/3б такође може одражавати пластичност која није повезана са оптерећењем пажње.
 БА2 и С2 добијају пројекције од БА1/3б, као и од различитих делова вентропостериорног таламичког комплекса (Понс ет ал., 1985; Фриедман и Мурраи, 1986). Оба ова мозак подручја имају велика, често вишецифрена (БА2) или билатерална (С2) рецептивна поља (Понс ет ал., 1985; Ивамура ет ал., 2002). На основу анатомских пројекција и својстава неуронског одговора, демонстрирана је хијерархијска обрада тактилних информација од БА1/3б до БА 2 (Каас ет ал., 2002). Поред тога, електрофизиолошке студије на макакима (Понс ет ал., 1987) и магнетоенцефалографски подаци добијени код људи сугеришу да се серијска обрада тактилних инпута дешава од С1 до С2 код виших примата (Фрот и Маугуиере 1999; Дисбров ет ал. ., 2001). Неколико студија је показало да се БА2 првенствено активира обликом и закривљеношћу (Бодегард ет ал., 2001), док С2 може бити укључен у тактилно учење (Ридлеи и Еттлингер 1976; Мурраи и Мисхкин, 1984), подржавајући идеју да ове области мозга укључени су у соматосензорну обраду вишег реда. Наша психофизичка процена је показала да су пацијенти значајно оштећени при детекцији једноставних тактилних стимулуса и у тесту идентификације текстуре облика 1.5 година након операције (Таилор ет ал., 2008а). Овај последњи тест процењује способност пацијента да препозна карактеристике објекта док активно истражује облик или текстуру, што захтева интеграцију сензорних информација у деловима тела (Росен и Лундборг, 1998). Узето заједно, једна интерпретација наших података је да пацијенти са ПНИр-ом више обраћају пажњу на вибротактилни стимулус, што доводи до повећане активације мреже позитивне на задатак и БА1/3. Међутим, код ових пацијената, наши подаци имплицирају да области обраде вишег реда, као што су БА2 и С2, нису примиле тактилне информације, што, заузврат, може довести до стањивања кортекса и смањених БОЛД одговора.
БА2 и С2 добијају пројекције од БА1/3б, као и од различитих делова вентропостериорног таламичког комплекса (Понс ет ал., 1985; Фриедман и Мурраи, 1986). Оба ова мозак подручја имају велика, често вишецифрена (БА2) или билатерална (С2) рецептивна поља (Понс ет ал., 1985; Ивамура ет ал., 2002). На основу анатомских пројекција и својстава неуронског одговора, демонстрирана је хијерархијска обрада тактилних информација од БА1/3б до БА 2 (Каас ет ал., 2002). Поред тога, електрофизиолошке студије на макакима (Понс ет ал., 1987) и магнетоенцефалографски подаци добијени код људи сугеришу да се серијска обрада тактилних инпута дешава од С1 до С2 код виших примата (Фрот и Маугуиере 1999; Дисбров ет ал. ., 2001). Неколико студија је показало да се БА2 првенствено активира обликом и закривљеношћу (Бодегард ет ал., 2001), док С2 може бити укључен у тактилно учење (Ридлеи и Еттлингер 1976; Мурраи и Мисхкин, 1984), подржавајући идеју да ове области мозга укључени су у соматосензорну обраду вишег реда. Наша психофизичка процена је показала да су пацијенти значајно оштећени при детекцији једноставних тактилних стимулуса и у тесту идентификације текстуре облика 1.5 година након операције (Таилор ет ал., 2008а). Овај последњи тест процењује способност пацијента да препозна карактеристике објекта док активно истражује облик или текстуру, што захтева интеграцију сензорних информација у деловима тела (Росен и Лундборг, 1998). Узето заједно, једна интерпретација наших података је да пацијенти са ПНИр-ом више обраћају пажњу на вибротактилни стимулус, што доводи до повећане активације мреже позитивне на задатак и БА1/3. Међутим, код ових пацијената, наши подаци имплицирају да области обраде вишег реда, као што су БА2 и С2, нису примиле тактилне информације, што, заузврат, може довести до стањивања кортекса и смањених БОЛД одговора.
Сматра се да инсула игра улогу у интеграцији мултимодалних информација важних за сензомоторне, емоционалне, алостатске/хомеостатске и когнитивне функције (Девински ет ал., 1995; Цритцхлеи, 2004; Цраиг, 2008) и означена је као лимбички сензорни кортекс (Цраиг , 2008). Неколико студија је известило о активацији острва као одговору на тактилну стимулацију (Гелнар ет ал., 1998;
Довнар ет ал., 2002) и анатомске студије праћења примата су показале да је инсула реципрочно повезана са фронталним, паријеталним и темпоралним режњевима (Аугустине, 1996). Код наших пацијената, десна предња инсула била је једина кортикална област која је показала значајно стањивање коре у комбинацији са смањеним вредностима фракционе анизотропије у суседној белој материји, што сугерише да је стањивање коре у овом региону повезано са губитком влакана која излазе на или из ову структуру. Десна предња инсула је укључена у интероцепцију јер је смештена да интегрише хомеостатски унос из тела са мотивационим, емоционалним и социјалним условима (Цраиг, 2008). Штавише, Цритцхлеи ет ал. (2004) су објавили корелацију између интероцептивних способности и запремине сиве материје десне предње инсуле. С обзиром на наше откриће да пацијенти имају смањену количину сиве материје у десној предњој инсули, било би од интереса да се у будућој студији процене интероцептивне способности након повреде периферног нерва.
Узети заједно, по први пут смо показали да су функционалне и структурне промене присутне у људској можданој кори 1.5 година након потпуне трансекције периферног нерва горњег екстремитета који је микрохируршки поправљен. Поред тога, мере нервне проводљивости указују на непотпуну периферну регенерацију код ових пацијената. Надаље, показујемо да је дебљина кортекса повезана са психофизичким мерама опоравка, при чему је тањи кортекс унутар БА2 и С2 био повезан са лошијом соматосензорном функцијом. Ови подаци сугеришу да је поновно успостављање нормалних функционалних активационих мапа директно повезано са успешном регенерацијом периферних аферената.
Кери С. Таилор,1,2 Димитри Ј. Анастакис2,3,4 и Карен Д. Давис1,2,3
1 Дивисион оф Браин, Имагинг анд Бехавиор � Системс Неуросциенце, Торонто Вестерн Ресеарцх Институте, Универзитетска здравствена мрежа, Торонто, Канада М5Т258
2 Институт за медицинске науке, Универзитет у Торонту, Канада
3 Одељење за хирургију, Универзитет у Торонту, Канада
4 Ресурсни центар за клиничке студије, Западни истраживачки институт у Торонту, Универзитетска здравствена мрежа, Торонто, Канада М5Т2С8
Преписка са: Карен Д. Давис, др.
Одељење за мозак, слике и понашање – системске неуронауке, Западни истраживачки институт у Торонту,
Западна болница у Торонту,
Универзитетска здравствена мрежа,
Соба МП14-306, 399 Батхурст Стреет,
Торонто, Онтарио,
Канада М5Т 2С8
Е-маил: кдавис@ухнрес.уторонто.ца
Признања
Аутори захваљују господину Геоффу Попеу, др Адриану Цравлеиу, господину Еугенеу Хласнију и господину Кеитх Та на стручној техничкој помоћи. Аутори желе да се захвале др Петеру Асхбију и господину Фредди Паизу са ЕМГ клинике Вестерн Хоспитал у Торонту на спровођењу тестова нервне проводљивости и на стручној процени налаза. Аутори такође захваљују др Двали, Бинхаммеру, Фиалкову и Антонисхину на сарадњи на овом пројекту. Др Дејвис је канадска катедра за истраживање мозга и понашања (ЦИХР МОП 53304).
Финансирање
Тхе Пхисицианс' Сервицес Инцорпоратед и заједнички грант од Центра за проучавање бола Универзитета у Торонту/АстраЗенеца.
Додатни материјал
Додатни материјал је доступан на Браин онлајн.
празан
Референце:
Апкариан АВ, Соса И, Сонти С, ет ал. Хронични бол у леђима је повезан са
смањена префронтална и таламичка густина сиве материје. Ј Неуросци
2004; 24: 10410�5.
Артхурс ОЈ, Јохансен-Берг Х, Маттхевс ПМ, Бонифаце СЈ. Пажња
различито модулира спајање фМРИ БОЛД и евоцираног
потенцијалне амплитуде сигнала у људском соматосензорном кортексу 7.
Екп Браин Рес 2004; 157: 269.
Августин ЈР. Круг и функционални аспекти инсуларног режња
код примата укључујући људе. Браин Рес Браин Рес Рев 1996; 22:
229�44.
Беаулиеу Ц. Основе анизотропне дифузије воде у нервном
систем – технички преглед. НМР Биомед 2002; 15: 435�55.
Бодегард А, Геиер С, Грефкес Ц, Зиллес К, Роланд ПЕ. Хијерархијски
обрада тактилног облика у људском мозгу. Неурон 2001; 31:
317�28.
Цраиг АД. Интероцепција и емоције: неуроанатомска перспектива.
У: Левис М, Хавиланд-Јонес Ј, Барретт Л, уредници. Хандбоок оф
емоције. Нев Иорк: Гуилдфорд Пресс; 2008. стр. 272�87.
Цритцхлеи ХД. Људски кортекс одговара на интероцептивни изазов.
Проц Натл Ацад Сци УСА 2004; 101: 6333�4.
Цритцхлеи ХД, Виенс С, Ротсхтеин П, Охман А, Долан РЈ. Неурални системи
подржава интероцептивну свест. Нат Неуросци 2004; 7: 189.
Дале АМ, Фисцхл Б, Серено МИ. Анализа кортикалне површине. И. Сегментација
и реконструкција површине. Неуроимаге 1999; 9: 179.
Давис КД, Попе Г, Цхен Ј, Кван ЦЛ, Цравлеи АП, Диамант НЕ. Кортикални
проређивање код ИБС-а: импликације за хомеостатику, пажњу и бол
обрада. Неурологи 2008; 70: 153�4.
ДеЛуца М, Бецкманн ЦФ, Де СН, Маттхевс ПМ, Смитх СМ. фМРИ мировање
државне мреже дефинишу различите начине интеракција на даљину
у људском мозгу. Неуроимаге 2006; 29: 1359�67.
Девински О, Моррелл МЈ, Вогт БА. Доприноси предњег цингулата
кортекс на понашање. Браин 1995; 118 (Пт 1): 279.
Дисбров Е, Робертс Т, Поеппел Д, Крубитзер Л. Докази за интерхемисферу
обрада уноса из руку у људском С2
и ПВ. Ј Неуропхисиол 2001; 85: 2236�44.
Довнар Ј, Цравлеи АП, Микулис ДЈ, Давис КД. Кортикална мрежа је осетљива
да стимулишу истакнутост у неутралном бихевиоралном контексту у вишеструким
чулни модалитети. Ј Неуропхисиологи 2002; 87: 615�20.
Драгански Б, Мосер Т, Луммел Н, ет ал. Смањење таламичке сиве
материја након ампутације екстремитета. Неуроимаге 2006; 31: 951�7.
Фисцхл Б, Дале АМ. Мерење дебљине коре великог мозга човека
са слика магнетне резонанце. Проц Натл Ацад Сци УСА 2000; 97:
11050�5.
Фисцхл Б, Серено МИ, Дале АМ. Анализа кортикалне површине. ИИ:
Инфлација, спљоштење и координатни систем заснован на површини.
Неуроимаге 1999а; 9: 195�207.
Фисцхл Б, Серено МИ, Тоотелл РБ, Дале АМ. Интерсубјецт високе резолуције
усредњавање и координатни систем за површину коре. Хум Браин
Мап 1999б; 8: 272�84.
Флоренце СЛ, Кас ЈХ. Реорганизација великих размера на више нивоа
соматосензорни пут прати терапијску ампутацију шаке
код мајмуна. Ј Неуросци 1995; 15: 8083�95.
Фок МД, Снидер АЗ, Винцент ЈЛ, Цорбетта М, Ван Е, Раицхле МЕ. Тхе
људски мозак је суштински организован у динамичан, антикорелисан
функционалне мреже. Проц Натл Ацад Сци УСА 2005; 102: 9673�9678.
Фриедман ДП, Мурраи ЕА. Таламусна повезаност другог
соматосензорно подручје и суседна соматосензорна поља
латерална бразда макака. Ј Цомп Неурол 1986; 252: 348�73.
Фрот М, Маугуиере Ф. Тајминг и просторна дистрибуција соматосензора
одговори забележени у горњој обали силвијеве пукотине (СИИ област) у
људи. Цереб Цортек 1999; 9: 854�63.
Геха ПИ, Балики МН, Харден РН, Бауер ВР, Паррисх ТБ, Апкариан АВ.
Мозак код хроничног ЦРПС бола: абнормална сиво-бела материја
интеракције у емоционалним и аутономним регионима. Неурон 2008; 60:
570�81.
Гелнар ПА, Краусс БР, Сзеверении НМ, Апкариан АВ. Представа на врху прста
у људском соматосензорном кортексу: фМРИ студија.
Неуроимаге 1998; 7: 261�83.
Хицкмотт ПВ, Стеен ПА. Велике промене у дендритској структури
током реорганизације соматосензорног кортекса одраслих. Нат Неуросци
2005; 8: 140�42.
Ивамура И, Танака М, Ирики А, Таока М, Тода Т. Процессинг оф
тактилне и кинестетичке сигнале са билатералних страна тела у
постцентрални гирус будних мајмуна. Бехав Браин Рес 2002; 135:
185�90.
Јакует ЈБ, Луијстербург АЈ, Калмијн С, Куиперс ПД, Хофман А, Ховиус СЕ.
Повреде средњег, улнарног и комбинованог медијан-улнарног нерва: функционалне
исход и повратак продуктивности. Ј Траума 2001; 51: 687.
Јуркиевицз МТ, Цравлеи АП, Верриер МЦ, Фехлингс МГ, Микулис ДЈ.
Соматосензорна кортикална атрофија након повреде кичмене мождине: базирана на вокселу
студија морфометрије. Неурологи 2006; 66: 762�4.
Каас ЈХ. Пластичност сензорних и моторичких карата код одраслих сисара. Анну
Рев Неуросци 1991; 14: 137�67.
Каас ЈХ, Јаин Н, Ки ХКС. Организација соматосензорног система у
примати. У: Нелсон РЈ, уредник. Соматосензорни систем.
Вашингтон, ДЦ: ЦРЦ Пресс; 2002. стр. 1�25.
Кимура Ј. Електродијагностика у болестима нерава и мишића: принципи
и пракса. Окфорд: Окфорд Университи Пресс; 2001.
Кимура Ј. Принципи и замке студија нервне проводљивости. Анн Неурол
1984; 16: 415�29.
Книихар-Цсиллик Е, Ракић П, Цсиллик Б. Транснеуронска дегенерација у
Роландова супстанца кичмене мождине примата коју изазива
аксотомијом изазвана трансганглијска дегенеративна атрофија централне
примарни сензорни терминали. Целл Тиссуе Рес 1989; 258: 515�25.
Лисс АГ, аф Екенстам ФВ, Виберг М. Губитак неурона у дорзалном корену
ганглија након трансекције периферног сензорног нерва. Анатомски
проучавање код мајмуна. Сцанд Ј Пласт Рецонстр Сург Ханд Сург 1996; 30: 1�6.
Лотзе М, Флор Х, Гродд В, Ларбиг В, Бирбаумер Н. Фантомски покрети
и бол. фМРИ студија код ампутираних горњих удова. Браин 2001;
124: 2268�77.
Мандуцх М, Безухли М, Анастакис ДЈ, Цравлеи АП, Микулис ДЈ. Сериал
фМРИ адаптивних промена у примарном сензомоторном кортексу
реконструкција палца. Неурологи 2002; 59: 1278�81.
Маи А. Хронични бол може променити структуру мозга. Паин 2008;
137: 7�15.
МцАллистер РМ, Гилберт СЕ, Цалдер ЈС, Смитх ПЈ. Епидемиологија и
збрињавање повреда периферних нерава горњих екстремитета у модерним
пракса. Ј Ханд Сург (Бр) 1996; 21: 4�13.
Мурраи ЕА, Мисхкин М. Релативни доприноси СИИ и ареа5 тактилном
дискриминација код мајмуна 2. Бехав Браин Рес 1984; 11: 67�83.
Нападов В, Кетнер Н, Рајан А, Квонг КК, Одет Ј, Хуи КК.
Соматосензорна кортикална пластичност у синдрому карпалног тунела - пресек
фМРИ евалуација. Неуроимаге 2006; 31: 520к30.
Олдфиелд РЦ. Процена и анализа руку: Единбург
инвентар. Неуропсицхологиа 1971; 9: 97�113.
Понс ТП, Гаррагхти ПЕ, Цусицк ЦГ, Каас ЈХ. Соматотопска организација
површине 2 код мајмуна макакија 6. Ј Цомп Неурол 1985; 241: 445�66.
Понс ТП, Гаррагхти ПЕ, Фриедман ДП, Мисхкин М. Физиолошки докази
за серијску обраду у соматосензорном кортексу. Сциенце 1987; 237:
417�20.
Порро ЦА, Луи Ф, Фаццхин П, Маиерон М, Баралди П. Активност у вези са перцепцијом
у соматосензорном систему човека: функционална магнетна резонанца
студије сликања. Магн Ресон Имагинг 2004; 22: 1539�48.
Повелл ТП, Ерулкар С. Транснеуронал целл дегенератион ин тхе аудитори
релејна језгра мачке. Ј Анат 1962; 96: 249.
Ридлеи РМ, Еттлингер Г. Оштећено тактилно учење и задржавање након
уклањања друге соматске сензорне пројекције кортекса (СИИ) у
мајмун. Браин Рес 1976; 109: 656.
Росен Б, Лундборг Г. Нови инструмент тактилне гнозе у сензибилности
тестирање. Ј Ханд Тхер 1998; 11: 251�7.
Семиновицз ДА, Давис КД. Бол побољшава функционалну повезаност
мождане мреже изазване обављањем когнитивног задатка.
Ј Неуропхисиол 2007; 97: 3651�9.
Смитх СМ, Јенкинсон М, Јохансен-Берг Х, ет ал. Просторно засновано на тракту
статистика: вокселна анализа вишепредметних података о дифузији.
Неуроимаге 2006; 31: 1487�1505.
Талаирацх Ј, Тоурноук П. Копланарни стереотаксички атлас људског мозга.
Њујорк: Тхиеме Медицал Публисхерс Инц.; 1988.
Таилор КС, Анастакис ДЈ, Давис КД. Хронични бол након периферног
повреда нерва је повезана са катастрофалним болом и неуротицизмом.
Инт Асс Студ Паин 2008а; 267.
Таилор КС, Давис КД. Стабилност фМРИ тактилног и бола
мождане активације: испитивање зависних од прага и
методе независне од прага. Хум Браин Мап 2009; 30:
1947�62.
Таилор КС, Семиновицз ДА, Давис КД. Два система стања мировања
повезаност између инсуле и цингуларног кортекса. Хум Браин
Мап 2008б;ДОИ:10.1002/хбм.20705.
Валл ЈТ, Каас ЈХ, Сур М, Нелсон РЈ, Феллеман ДЈ, Мерзеницх ММ.
Функционална реорганизација у соматосензорним кортикалним подручјима 3б и 1
одраслих мајмуна након поправке средњег нерва: могући однос према
сензорни опоравак код људи. Ј Неуросци 1986; 6: 218�33.
Затвори Хармоника
Информације овде о „Исецање нерва мења вам мозак | Ел Пасо, Тексас." није намењен да замени однос један на један са квалификованим здравственим радником или лиценцираним лекаром и није медицински савет. Подстичемо вас да доносите одлуке о здравственој заштити на основу вашег истраживања и партнерства са квалификованим здравственим радником.
Информације о блогу и дискусије о обиму
Наш обим информација је ограничен на киропрактику, мускулоскелетну, физикалне лекове, веллнесс, доприносећи етиолошкој висцеросоматски поремећаји унутар клиничких презентација, повезане клиничке динамике соматовисцералног рефлекса, комплекса сублуксације, осетљивих здравствених проблема и/или чланака, тема и дискусија функционалне медицине.
Пружамо и представљамо клиничка сарадња са специјалистима из разних дисциплина. Сваки специјалиста се руководи својим професионалним обимом праксе и јурисдикцијом лиценцирања. Користимо функционалне здравствене и веллнесс протоколе за лечење и подршку нези повреда или поремећаја мишићно-скелетног система.
Наши видео снимци, постови, теме, теме и увиди покривају клиничка питања, проблеме и теме које се односе на и директно или индиректно подржавају наш клинички обим праксе.*
Наша канцеларија је разумно покушала да обезбеди цитате у прилог и идентификовала је релевантну истраживачку студију или студије које подржавају наше објаве. На захтев пружамо копије пратећих истраживачких студија доступне регулаторним одборима и јавности.
Разумемо да покривамо питања која захтевају додатно објашњење како то може помоћи у одређеном плану неге или протоколу лечења; зато, да бисте даље разговарали о горњој теми, слободно питајте Др Алек Јименез, ДЦ, или нас контактирајте 915-850-0900.
Овде смо да помогнемо вама и вашој породици.
Благослови
Др. Алек Јименез ДЦ, МСАЦП, РН*, ЦЦСТ, ИФМЦП*, ЦИФМ*, АТН*
e-маил: цоацх@елпасофунцтионалмедицине.цом
Лиценцирани као доктор киропрактике (ДЦ) у Тексас & Нови Мексико*
Тексас ДЦ лиценца бр. ТКСКСНУМКС, Нев Мекицо ДЦ Лиценца # НМ-ДЦ2182
Лиценцирана као медицинска сестра (РН*) in Флорида
Флорида лиценца РН лиценца # РНКСНУМКС (Контролни бр. 3558029)
Компактни статус: Вишедржавна лиценца: Овлашћени за праксу у КСНУМКС државе*
Др Алек Јименез ДЦ, МСАЦП, РН* ЦИФМ*, ИФМЦП*, АТН*, ЦЦСТ
Моја дигитална визит карта