Алессио Ненциони, Ирене Цаффа, Салваторе Цортеллино
Резиме | Рањивост ћелија карцинома на недостатак хранљивих састојака и њихова зависност од одређених метаболита постају обележје рака. Дијета наташте или имитирање поста (ФМД) доводи до широких промена у факторима раста и у нивоу метаболита, стварајући окружења која могу смањити способност ћелија карцинома да се прилагоде и преживе и на тај начин побољшавају ефекте терапија карцинома. Поред тога, пост или синдром ФМД повећавају отпорност на хемотерапију у нормалним, али не и ћелијама карцинома, и подстичу регенерацију у нормалним ткивима, што би могло помоћи у спречавању штетних и потенцијално опасних по живот нежељених ефеката лечења. Иако пацијенти тешко подносе пост, и животињске и клиничке студије показују да су циклуси нискокалоричних слинавих тумора изводљиви и у целини безбедни. У току је неколико клиничких испитивања која процењују ефекат поста или слинавке шупљине на нежељене догађаје који се јављају током лечења и на исходе ефикасности. Предлажемо да комбинација ФМД-а са хемотерапијом, имунотерапијом или другим третманима представља потенцијално обећавајућу стратегију за повећање ефикасности лечења, спречавање стицања резистенције и смањење нежељених ефеката.
Дијета и фактори везани за начин живота кључне су детерминанте ризика од развоја рака, при чему су одређени карциноми више зависни од навика у исхрани од других1�
Иако смо у протеклој деценији били сведоци невиђених промена и изузетног напретка у лечењу карцинома14,15, и даље остаје пресудна потреба за ефикаснијим и, могуће,
Пост приморава здраве ћелије да уђу у полагану поделу и високо заштићен режим који их штити од токсичних увреда проистеклих из лекова против рака, док истовремено сензибилизира различите врсте ћелија карцинома на ове терапије11,12,17. Ово откриће имплицира да би појединачна дијететска интервенција могла да помогне у решавању различитих и подједнако важних аспеката терапије карцинома.
У овом чланку о Мишљењу расправљамо о биолошким разлозима за употребу дијета наташте или опонашања поста за отупљивање ТЕАЕ, али и за спречавање и лечење рака. Такође илуструјемо упозорења овог експерименталног приступа18,19 и објављене и текуће клиничке студије у којима су пост или синдром ФМД примењени на пацијенте са раком.
Садржај
Системски и ћелијски одговор наташте
Пост доводи до промена у активности многих метаболичких путева повезаних са пребацивањем у режим који може да генерише енергију и метаболите користећи изворе угљеника који се ослобађају првенствено из масног ткива, а делом из мишића. Промене у нивоу циркулишућих хормона и метаболита преводе се у смањење дељења ћелија и метаболичка активност нормалних ћелија и на крају их заштити од хемотерапијских увреда11,12. Ћелије рака, непоштовањем наредби против раста које диктирају ови услови гладовања, могу имати супротан одговор од нормалних ћелија и стога постају сензибилисане на хемотерапију и друге терапије рака.
Системски одговор на пост
Одговор на пост делимично је организован циркулацијом нивоа глукозе, инсулина, глукагона, хормона раста (ГХ), ИГФ1, глукокортикоида
Глукагон и низак ниво инсулина такође стимулишу разградњу триглицерида (који се углавном складиште у масном ткиву) у глицерол и слободне масне киселине. Током поста, већина ткива користи масне киселине за енергију, док се мозак ослања на глукозу и кетонска тела произведена од хепатоцита (кетонска тела се могу произвести из ацетил-ЦоА генерисаног α-оксидацијом масних киселина или из кетогених амино киселина). У кетогеној фази поста, кетонска тела достижу концентрације у милимоларном опсегу, обично почевши од 2 дана од почетка поста. Заједно са глицеролом и аминокиселинама добијеним из масти, кетонска тела потичу глуконеогенезу, која одржава нивое глукозе у концентрацији од приближно 3 мМ (4 мг по дл), коју мозак углавном користи.
Глукокортикоиди и адреналин такође доприносе усмеравању метаболичких адаптација на
Коначно, пост смањује нивое лептина у циркулацији, хормона који углавном стварају адипоцити који инхибира глад, док истовремено повећава ниво адипонектина, који повећава разградњу масних киселина23,24. Дакле, у закључку, обележја системског одговора сисара на пост су ниски нивои глукозе и инсулина, високи нивои глукагона и кетонских тела, низак ниво ИГФ1 и лептина и високи нивои адипонектина.
Ћелијски одговор на пост
Реакција здравих ћелија на гладовање је еволутивно очувана и даје ћелијску заштиту, а показало се да барем код моделних организама продужава животни и здравствени век12,22,25. ИГФ31
Пост и резултирајућа рестрикција глукозе инхибирају активност ПКА, повећавају активност АМПК и активирају ЕГР1 и на тај начин постижу заштитне ефекте ћелија, укључујући оне у миокарду22,25,26. На крају, пост и ФМД (видети њихов састав у наставку) такође имају способност да промовишу регенеративне ефекте (Оквир 1) молекуларним механизмима, од којих су неки умешани у рак, као што је повећана аутофагија или индукција активности сиртуина22,37�49 .

Дијетални приступи код синдрома карцинома
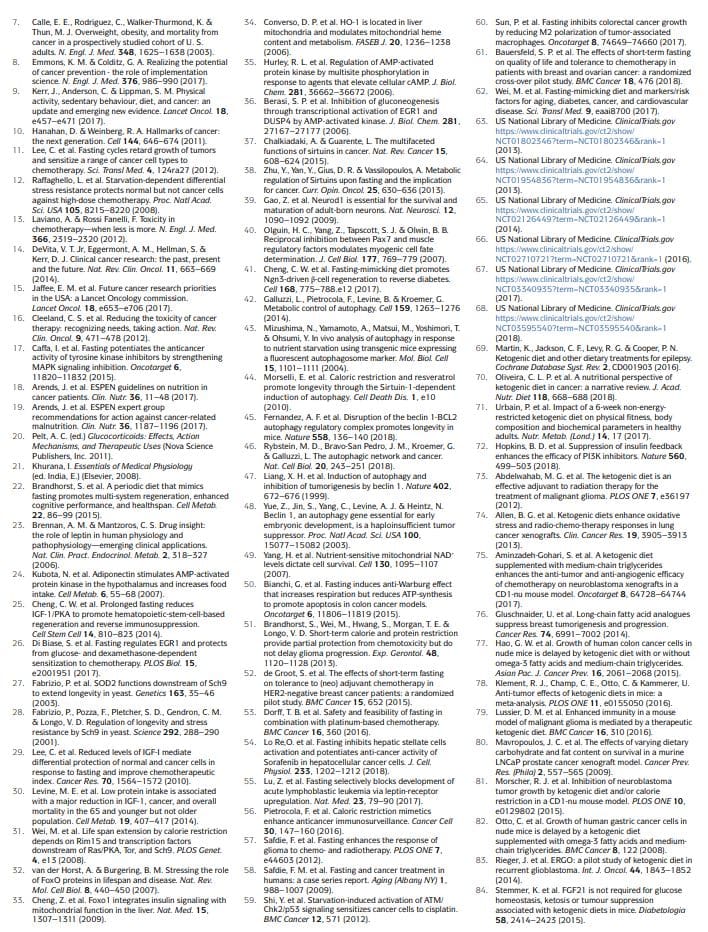
Приступи исхрани засновани на гладовању који су детаљније истражени у онкологији, како претклинички тако и клинички, укључују гладовање на води (апстиненција од све хране и пића осим воде) и ФМД11,12,17,25,26,50�60 (табела 1). Прелиминарни клинички подаци указују на то да може бити потребан пост од најмање 48 сати да би се постигли клинички значајни ефекти у онкологији, као што је спречавање оштећења ДНК изазване хемотерапијом здравих ткива и помоћ у одржавању
Међутим, већина пацијената одбија или има потешкоће да доврши пост на води, а тешко је оправдати потенцијалне ризике од повећаног калоријског и микронутријенског дефицита који је повезан са тим. ФМД су медицински дизајнирани режими исхране са веома ниским садржајем калорија (то јест, обично између 300 и 1,100 кцал дневно), шећера и протеина који поново стварају многе ефекте гладовања само на води, али са бољом усклађеношћу пацијената и смањеним ризиком од исхране22,61,62, 3. Током ФМД-а, пацијенти обично добијају неограничене количине воде, мале, стандардизоване порције чорба од поврћа, супа, сокова, орашастих плочица и биљних чајева, као и суплемената микронутријената. У клиничкој студији од 5 месечна циклуса 1-дневног ФМД-а код генерално здравих субјеката, исхрана је била добро толерисана и смањила је труп и укупну телесну масноћу, крвни притисак и нивое ИГФ62. У претходним и текућим онколошким клиничким испитивањима, гладовање или ФМД су обично давани сваке 3 недеље, на пример, у комбинацији са режимима хемотерапије, а њихово трајање се кретало између 4 и 1 дана5�52,53,58,61,63 . Важно је да у овим студијама нису пријављени никакви озбиљни нежељени догађаји (ниво Г68 или виши, према заједничким терминолошким критеријумима за нежељене догађаје)3.
Кетогена дијета
Кетогене дијете (КД) су прехрамбени режими који имају нормалан садржај калорија, масти и мало угљених хидрата69,70. У класичном КД, однос између тежине масти и заједничке тежине угљених хидрата и протеина је 4: 1. Треба напоменути да су ФМД такође кетогени јер садрже висок садржај масти и имају способност да изазову значајна повишења (? 0.5 ммол по литру) нивоа циркулишућих кетонских тела. Код људи, КД такође може смањити ниво ИГФ1 и ниво инсулина (за више од 20% од почетних вредности), мада на ове ефекте утичу нивои и врсте угљених хидрата и протеина у исхрани71. КД могу смањити ниво глукозе у крви, али обично остају у границама нормале (то јест,> 4.4 ммол по литру) 71.
Посебно, КД могу бити ефикасни за спречавање повећања глукозе и инсулина који се обично јавља као одговор на инхибиторе ПИ3К, за које је предложено да ограничи њихову ефикасност72. Традиционално, КД се користе за лечење рефракторне епилепсије, углавном код деце69. У моделима миша, КД индукују антиканцерогене ефекте, посебно код глиобластома70,72. Клиничке студије показују да КД вероватно немају значајну терапијску активност када се користе као појединачни агенси код пацијената са раком и сугеришу да потенцијалне користи од ових дијета треба тражити у комбинацији са другим приступима, као што су хемотерапија, радиотерапија, антиангиогене терапије, ПИ86К инхибитори
Извештено је да КД имају неуропротективне ефекте у периферним нервима и у хипокампусу87,88. Међутим, остаје да се утврди да ли КД такође имају прорегенеративне ефекте сличне гладовању или ФМД (Оквир 1) и да ли се КД такође могу користити за заштиту живих сисара од токсичности хемотерапије. Посебно се чини да се регенеративни ефекти поста или синдрома појаве појаве појачавају максимализмом пребацивањем из режима гладовања, који укључује разградњу ћелијских компоненти и смрт многих ћелија, као и период поновног храњења током којег ћелије и ткива пролазе реконструкција22. Будући да КД не форсирају улазак у режим гладовања, не подстичу велико распадање унутарћелијских компонената и ткива и не укључују период прихране, мало је вероватно да ће проузроковати врсту координисане регенерације примећене током прихрањивања слинавке.
Ограничење калорија
Док се хронична калоријска рестрикција (ЦР) и дијете са недостатком специфичних аминокиселина веома разликују од периодичног гладовања, они деле са постом и ФМД мање или више селективно ограничење хранљивих материја и имају антиканцерогене ефекте81,89�112. ЦР обично укључује хронично смањење уноса енергије за 20% у односу на стандардни унос калорија што би омогућило појединцу да одржи нормалну тежину30. Веома је ефикасан у смањењу кардиоваскуларних фактора ризика и инциденције рака код моделних организама, укључујући примате113,114.
Међутим, ЦР може изазвати нежељене ефекте, као што су промене у физичком изгледу, повећана осетљивост на хладноћу, смањена снага, менструалне неправилности, неплодност, губитак либида, остеопороза, спорије зарастање рана, опсесија храном, раздражљивост и депресија. Код пацијената са карциномом постоји велика забринутост да то може погоршати потхрањеност и да ће неизбежно изазвати прекомерни губитак немасне телесне масе18,113�116. ЦР смањује нивое глукозе у крви наташте, иако остају у границама нормале114. Код људи, хронични ЦР не утиче на нивое ИГФ1 осим ако се такође не примени умерено ограничење протеина117.
Студије показују да смањењем сигнала мТОРЦ1 у Панетх ћелијама, ЦР повећава њихову функцију матичних ћелија и да такође штити резервне матичне ћелије црева од оштећења ДНК118,119, али је непознато да ли ЦР изазива и про-регенеративне ефекте у другим органима. Према томе, доступни подаци сугеришу да пост и синдром ФМД стварају метаболички, регенеративни и заштитни профил који је различит и вероватно снажнији од оног који изазивају КД или ЦР.
Пост и синдром ФМД у терапији: Утицај на ниво хормона и метаболита
Многе промене у нивоу циркулишућих хормона и метаболита које се обично примећују као одговор на пост имају способност да испољавају антитуморске ефекте (то јест, смањени ниво глукозе, ИГФ1, инсулина и лептина и повећани нивои адипонектина) 23,120,121 и / или да приуште заштиту здравих ткива од нежељених ефеката (односно смањених нивоа ИГФ1 и глукозе). Будући да кетонска тела могу да инхибирају хистонске деацетилазе (ХДАЦ), повећање кетонских тела изазвано гладовањем може помоћи у успоравању раста тумора и подстицању диференцијације путем епигенетских механизама122.
Међутим, показало се да ацетоацетат кетонског тела убрзава, уместо да смањује, раст одређених тумора, као што су меланоми са мутираним БРАФ123. Оне промене за које постоје најснажнији докази о улози у благотворним ефектима поста и ФМД против рака су смањење нивоа ИГФ1 и глукозе. На молекуларном нивоу, пост или ФМД смањују интрацелуларне сигналне каскаде укључујући ИГФ1Р�АКТ�мТОР�С6К и цАМП�ПКА сигнализацију, повећавају аутофагију, помажу нормалним ћелијама да издрже стрес и промовишу имунитет против рака25,29,56,124
Отпорност на диференцијални стрес: Повећавање подношљивости хемотерапије
Неки ортолози онкогеног квасца, попут Рас и Сцх9 (функционални ортолог сисара С6К), способни су да смање отпорност на стрес у моделним организмима27,28. Поред тога, мутације које активирају ИГФ1Р, РАС, ПИ3КЦА или АКТ или које инактивирају ПТЕН, присутне су у већини људских карцинома10. Заједно, ово је довело до хипотезе да би гладовање изазвало супротне ефекте код рака у односу на нормалне ћелије у смислу њихове способности да издрже ћелијске стресоре, укључујући хемотерапеутике. Другим речима, гладовање може довести до
Према хипотези ДСР, нормалне ћелије реагују на изгладњивање смањењем регулације пролиферације повезане и биогенезе рибозома и / или гена за скупљање, што приморава ћелије да уђу у режим самоодржавања и штите их од оштећења изазваних хемотерапијом, радиотерапијом и другим токсичним агенсима. Супротно томе, у ћелијама карцинома, овај начин самоодржавања спречава се онкогеним променама, које узрокују конститутивну инхибицију путева одговора на стрес12 (слика 1). У складу са ДСР моделом, краткотрајним гладовањем или брисањем прото-онкогена
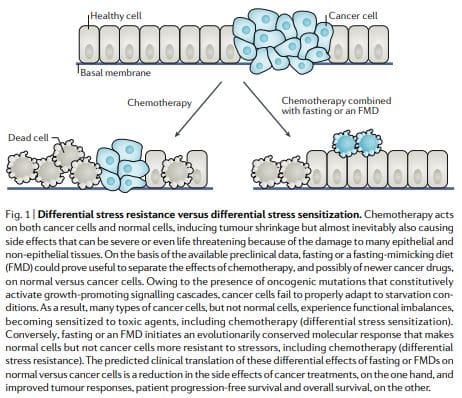
Слични резултати су добијени у ћелијама сисара: излагање медијумима са ниским садржајем глукозе заштитило је примарне ћелије глије миша од токсичности од водоник-пероксида или циклофосфамида (хемотерапеутски прооксидант), али није заштитило ћелијске линије рака миша, пацова и човека и неуробластома. У складу са овим запажањима,
Накнадне студије су откриле да смањена сигнализација ИГФ1 као одговор на гладовање штити примарну глију и неуроне, али не и ћелије глиома и неуробластома, од циклофосфамида и од прооксидативних једињења и штити ембрионалне фибробласте миша од доксорубицина29. Мишеви са недостатком ИГФ1 (ЛИД) у јетри, трансгене животиње са условном делецијом гена за Игф1 јетре које показују смањење циркулишућих нивоа ИГФ70 за 80% (нивои слични онима постигнутим 1-сатним постом код мишева)72, били су заштићени од три од четири тестирана лека за хемотерапију, укључујући доксорубицин.
Хистолошка испитивања показала су знаке срчане миопатије изазване доксорубицином само код контролних мишева лечених доксорубицином, али не и код мишева ЛИД. У експериментима са животињама које носе меланом лечене доксорубицином, није примећена разлика у погледу прогресије болести између контролних и ЛИД мишева, што указује да ћелије карцинома нису заштићене од хемотерапије смањеним нивоом ИГФ1. Па ипак, ЛИД мишеви који су носили тумор показали су изузетну предност преживљавања у поређењу са контролним животињама захваљујући својој способности да издрже токсичност доксорубицина29. Дакле, у целини, ови резултати су потврдили да је смањење регулације ИГФ1 кључни механизам помоћу којег пост повећава подношљивост хемотерапије.
И дексаметазон и инхибитори мТОР се широко користе у лечењу карцинома, било због њихове ефикасности као антиеметичари и
Ове интервенције смањују активност ПКА док повећавају активност АМПК и на тај начин активирају ЕГР1, што указује да цАМП� ПКА сигнализација посредује ДСР изазван наташте преко ЕГР1 (реф. 26). ЕГР1 такође промовише експресију кардиопротективних пептида, као што су атријални натриуретски пептид (АНП) и натриуретски пептид Б типа (БНП) у срчаном ткиву, што доприноси отпорности на доксорубицин. Штавише, пост и/или ФМД могу заштитити мишеве од кардиомиопатије изазване доксорубицином појачавањем аутофагије, која може промовисати ћелијско здравље смањењем производње реактивних врста кисеоника (РОС) кроз елиминацију дисфункционалних митохондрија и уклањањем токсичних агрегата.
Поред смањења токсичности изазване хемотерапијом у ћелијама и повећаног преживљавања мишева третираних хемотерапијом, циклуси поста постижу регенерацију коштане сржи и спречавају имуносупресију изазвану циклофосфамидом на начин повезан са ПКА и ИГФ1. Стога, убедљиви предклинички резултати указују на потенцијал поста и синдрома ФМД да повећају подношљивост хемотерапије и избегну главне нежељене ефекте. Будући да почетни клинички подаци пружају додатну потпору овом потенцијалу, ове претклиничке студије граде снажно образложење за процену слинавке и шупљине у рандомизованим клиничким испитивањима са ТЕАЕ као примарном завршном тачком.
Сензибилизација за диференцијални стрес: Повећавање смрти ћелија рака
Ако се користе самостално, већина дијеталних интервенција, укључујући пост и слинавку ФМД, има ограничене ефекте против прогресије карцинома. Према хипотези о диференцијалној стресној сензибилизацији (ДСС), комбинација поста или ФМД-а са другим третманом је много обећавајућа11,12. Ова хипотеза предвиђа да, иако су ћелије карцинома способне да се прилагоде ограниченим концентрацијама кисеоника и хранљивих састојака, многе врсте ћелија карцинома нису у стању да изврше промене које би омогућиле преживљавање у хранљивом дефицијентном и токсичном окружењу генерисаном комбинацијом поста и хемотерапије , на пример. Рани експерименти у раку дојке, меланому
Сматрамо такав неодговарајући одговор ћелија карцинома на измењене услове, укључујући смањење нивоа ИГФ1 и нивоа глукозе узроковане постом или снуфом, као кључни механизам у основи

Смањујући доступност глукозе и повећавајући? -Оксидацију масних киселина, пост или синдром ФМД такође могу да подстакну прелазак са аеробне гликолизе (Варбургов ефекат) на митохондријску оксидативну фосфорилацију у ћелијама карцинома, која је неопходна за одржавање раста ћелија карцинома у окружењу са највише хранљивих састојака50 (Слика 2). Овај прелазак доводи до повећане производње РОС11 као резултат повећане респираторне активности митохондрија, а такође може да укључује смањење ћелијског редокс потенцијала услед смањене синтезе глутатиона из гликолизе и пута пентоза-фосфата50. Комбиновани ефекат повећања РОС-а и смањена антиоксидативна заштита појачава оксидативни стрес у ћелијама карцинома и појачава активност хемотерапеутика. Важно је напоменути да због тога што висока гликолитичка активност која се показује производњом високог лактата предвиђа агресивност и метастатску склоност код неколико врста карцинома129, анти-Варбургови ефекти поста или синдрома слинавке и јабуке могу бити посебно ефикасни против агресивних и метастатских карцинома.
Осим промене у метаболизму, пост или слинавац узрокују и друге промене које могу промовисати ДСС у ћелијама рака панкреаса. Пост повећава ниво експресије
Коначно, пост може повећати регулацију рецептора лептина и његових рецептора
Нарочито је вероватно да многи типови ћелија рака, укључујући АМЛ29, могу да стекну отпор заобилажењем метаболичких промена наметнутих постом или ФМД, што је могућност која је додатно повећана метаболичком хетерогеношћу која карактерише многе врсте рака129. Стога ће главни циљ у блиској будућности бити идентификовање типова рака који су најподложнији овим режимима исхране помоћу биомаркера. С друге стране, када се комбинују са стандардним терапијама, гладовање или ФМД ретко су довели до стицања резистенције код модела мишева рака, а отпорност на гладовање у комбинацији са хемотерапијом је такође неуобичајена у студијама ин витро, наглашавајући важност идентификовања терапија које, када се комбинују са ФМД, резултирају снажним токсичним ефектима на ћелије рака са минималном токсичношћу за нормалне ћелије и ткива11,17,50,55.
Појачавање антитуморског имунитета постом или синдромом синдрома
Најновији подаци сугеришу да пост или синдром ФМД сами по себи, и у већој мери у комбинацији са хемотерапијом, покрећу ширење лимфоидних родоначелника и промовишу
Дијете против рака у моделима мишева
Свеукупно, резултати предклиничких студија поста или ФМД-а на моделима карцинома животиња, укључујући моделе метастатског карцинома (Табела 2), показују да периодични пост или ФМД постижу плеиотропне антиканцерогене ефекте и потенцирају активност хемотерапеутика и ТКИ-а уз истовремено пружање заштитних и регенеративних ефеката у више органа22,25. Постизање истих ефеката без поста и / или слинавке и шупље болести захтевало би прво идентификацију, а затим употребу више ефикасних, скупих и често токсичних лекова, а вероватно би било без предности стварања здраве заштите ћелија. Значајно је да се у најмање две студије пост у комбинацији са хемотерапијом показао као једина интервенција способна да се постигне или потпуна регресија тумора или дугорочно преживљавање у доследном делу третираних животиња11,59
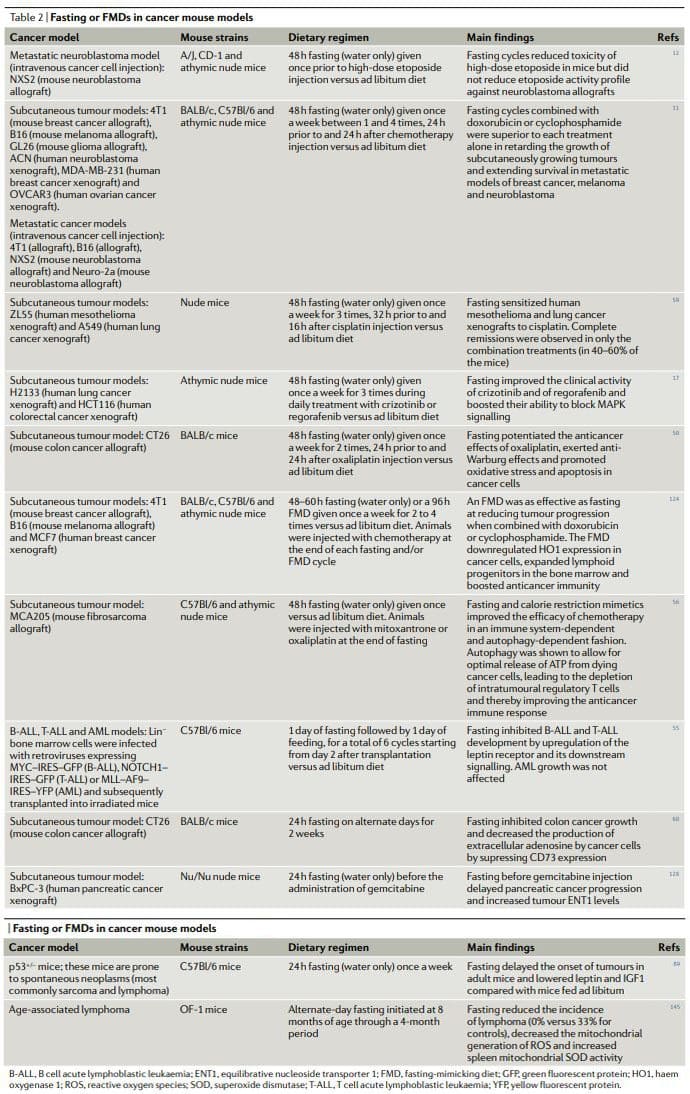
Хронични КД такође показују а
ЦР је смањио туморигенезу у генетским моделима рака мишева, моделима миша са спонтаном туморигенезом и канцерогеним индукованим моделима миша, као и код мајмуна91,92,97,98,101,102,104�106,108,109,136�138. Насупрот томе, студија је открила да ЦР од средњих година заправо повећава инциденцу неоплазми плазма ћелија код Ц57Бл/6 мишева139. Међутим, у истој студији, ЦР је такође продужио максимални животни век за отприлике 15%, а уочено повећање инциденције рака приписано је повећаном животном веку мишева који су били подвргнути ЦР, старости у којој
Важно је да је ЦР побољшао активност антиканцерогеног лечења на неколико модела карцинома, укључујући активност антиИГФ1Р антитела (ганитумаб) против карцинома простате141, циклофосфамида против ћелија неуробластома135 и инхибиције аутофагије у ксенографтовима ХРАС-Г12Втрансформисаних бесмртних епителних ћелија бебе миша100. Међутим, чини се да је ЦР или КД у комбинацији са терапијама против рака мање ефикасан од поста. Студија миша открила је да, за разлику од самог поста, само ЦР није у стању да смањи раст субкутано растућих ГЛ26 мишјих глиома и да, опет, за разлику од краткотрајног поста, ЦР није повећао активност цисплатина против поткожне 4Т1 дојке тумоурс51. У истој студији, пост се такође показао знатно ефикаснијим од ЦР и КД у повећању подношљивости доксорубицина51. Иако пост или слинавка, ЦР и КД вероватно делују и модулирају преклапање
Тада би фаза прихрањивања могла
Пост и слинавац у превенцији рака
Епидемиолошке студије и студије на животињама, укључујући мајмуне108,109,144, и људе подржавају идеју да би хронични ЦР и периодични пост и / или синдром ФМД могли имати превентивне ефекте на рак код људи. Ипак, ЦР се тешко може применити у општој популацији због питања усклађености и могућих нежељених ефеката115. Дакле, док се препоруке намирница заснованих на доказима преферирају (или их треба избегавати), као и препоруке животног стила за смањење ризика од рака, постају6,8,9,15, циљ је сада идентификовати и, можда, стандардизовати, периодично добро подношљиве дијететски режими са малим или никаквим нежељеним ефектима и процењују њихову превентивну ефикасност против рака у клиничким студијама.
Као што је раније речено, циклуси ФМД узрокују смањење регулације ИГФ1 и глукозе и регулацију ИГФБП1 и кетонских тела, што су промене сличне онима које узрокује само пост и био су маркери одговора на пост22. Када мишеви Ц57Бл / 6 (који се спонтано развијају
Претходна студија поста наизменичног дана, која се изводила код средњовековних мишева током укупно 4 месеца, такође је утврдила да је пост смањио учесталост лимфома, доводећи га са 33% (за контролне мишеве) на 0% (код гладовања животиње) 145, иако је због кратког трајања студије непознато да ли је овај режим поста спречио или једноставно одложио
Стога су обећавајући резултати предклиничких студија комбиновани са клиничким подацима о утицају слинавке и шупље на факторе ризика за
Клиничка применљивост у онкологији
Данас су објављене четири студије изводљивости поста и синдрома ФМД код пацијената на хемотерапији52,53,58,61. У серији случајева од 10 пацијената којима је дијагностикована разна врста карцинома, укључујући рак дојке, простате, јајника, материце, плућа и једњака, који су добровољно постили до 140 сати пре и / или до 56 сати након хемотерапије, нису изазвани већи нежељени ефекти постивши само пост, осим глади и несвестице58. Они пацијенти (шест) који су били подвргнути хемотерапији са постом и без њега, пријавили су значајно смањење умора, слабости и гастроинтестиналних нежељених догађаја током поста. Поред тога, код оних пацијената код којих се може проценити прогресија карцинома, пост није спречио смањење запремине тумора или туморских маркера изазвану хемотерапијом. У другој студији, 13 жена са ХЕР2 (такође познатим као ЕРББ2) негативним, рак дојке стадијума ИИ / ИИИ који је примао нео-адјувантну таксотере, адриамицин и циклофосфамид (ТАЦ) хемотерапију је рандомизирано на брзе (само у води) 24 сата пре и после почетка хемотерапије или до исхране према стандардним смерницама52.
Краткорочни пост се добро подносио и смањио је пад средњег броја еритроцита и тромбоцита 7 дана након хемотерапије. Занимљиво је да су у овој студији нивои? -Х2АКС (маркер оштећења ДНК) повећани 30 минута након хемотерапије у леукоцитима код пацијената који нису гладовали, али не и код пацијената који су постили. У ескалацији дозе наташте код пацијената који су подвргнути хемотерапији заснованој на платини, 20 пацијената (који су се првенствено лечили или од уротелија, рака јајника или дојке) насумично је постано 24, 48 или 72 сата (подељено на 48 сати пре хемотерапије и 24 сата после хемотерапије ) 53. Критеријуми изводљивости (дефинисани су као три или више од шест испитаника у свакој кохорти који конзумирају 200 кцал дневно током брзог периода без прекомерне токсичности). Токсичност у вези са постом
Недавно је спроведено рандомизирано унакрсно клиничко испитивање које је процењивало ефекте слинавке и шупље болести на квалитет живота и нежељене ефекте хемотерапије код укупно 34 пацијента са раком дојке или јајника61. ФМД се састојао од
Изазови на клиници
Проучавање периодичног поста или ФМД-а у онкологији није лишено забринутости, посебно у вези са могућношћу да ова врста режима исхране може убрзати неухрањеност, саркопенију,
Закључци
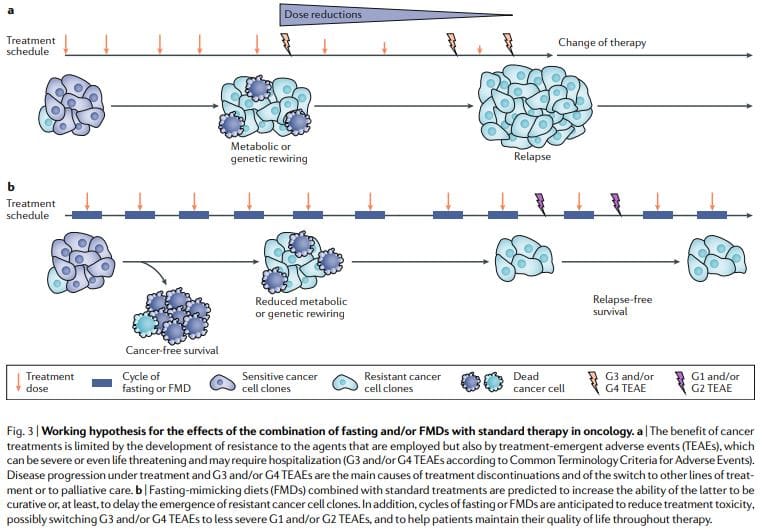
Периодични пост или слинавке и снужде стално показују моћне антиканцерогене ефекте у моделима карцинома миша, укључујући способност појачавања хеморадиотерапије и ТКИ и покретања антиканцерогеног имунитета. Циклуси слинавке и шупље изводљивији су од хроничних дијеталних режима, јер омогућавају пацијентима да редовно конзумирају храну током синдрома синдрома ФМД, одржавају нормалну исхрану између циклуса и не доводе до озбиљног губитка килограма и могуће штетних ефеката на имуни и ендокрини систем. Пре свега, као самосталне терапије, периодични циклуси поста или ФМД вероватно би показали ограничену ефикасност против утврђених тумора. У ствари, код мишева пост или синдром ФМД утичу на напредовање одређеног броја карцинома слично као и хемотерапија, али сами се ретко поклапају са ефектом добијеним у комбинацији са лековима против карцинома који могу резултирати преживљавањем без карцинома11,59. Стога предлажемо да управо комбинација периодичних циклуса ФМД са стандардним третманима има највећи потенцијал за промоцију преживљавања без карцинома код пацијената, као што су предложили модели миша11,59 (слика 3).
Ова комбинација може бити нарочито снажна из неколико разлога: прво, лекови против рака и друге терапије могу бити ефикасни, али један део пацијената не реагује, јер ћелије карцинома усвајају алтернативне метаболичке стратегије које воде ка преживљавању. Ове алтернативне метаболичке начине је много теже одржати под постом или условима слинавке шупље због недостатака или промена у глукози, одређеним аминокиселинама, хормонима и факторима раста, као и на другим непознатим путевима који воде до ћелијске смрти. Друго, пост или јабуке могу спречити или смањити стицање отпора. Треће, пост или синдром ФМД штите нормалне ћелије и органе од нежељених ефеката изазваних широким спектром лекова против рака. На основу претклиничких и клиничких доказа изводљивости, сигурности и ефикасности (при смањењу ИГФ1, висцерална масноћа
Даље, од суштинске је важности да се шампињони примењују са разумевањем механизама деловања, с обзиром на њихову снагу
Текуће клиничке студије ФМД код пацијената са карциномом63,65 пружиће поузданије одговоре о томе да ли прописивање периодичних ФМД у комбинацији са конвенционалним антиканцерогеним агенсима помаже у побољшању подношљивости и активности ових последњих. Важно је узети у обзир да ФМД неће бити ефикасне у смањењу нуспојава лечења карцинома код свих пацијената, нити ће радити на побољшању ефикасности свих терапија, али имају велики потенцијал да то учине барем за део и евентуално за већи део пацијената и лекова. Слаби или неухрањени пацијенти или пацијенти са ризиком од потхрањености не би требало да буду укључени у клиничке студије гладовања или ФМД-а, а статус ухрањености пацијената и анорексију треба пажљиво пратити током клиничких испитивања.
Референце:
Информације овде о „Пост и рак: молекуларни механизми и клиничка примена" није намењен да замени однос један на један са квалификованим здравственим радником или лиценцираним лекаром и није медицински савет. Подстичемо вас да доносите одлуке о здравственој заштити на основу вашег истраживања и партнерства са квалификованим здравственим радником.
Информације о блогу и дискусије о обиму
Наш обим информација је ограничен на киропрактику, мускулоскелетну, физикалне лекове, веллнесс, доприносећи етиолошкој висцеросоматски поремећаји унутар клиничких презентација, повезане клиничке динамике соматовисцералног рефлекса, комплекса сублуксације, осетљивих здравствених проблема и/или чланака, тема и дискусија функционалне медицине.
Пружамо и представљамо клиничка сарадња са специјалистима из разних дисциплина. Сваки специјалиста се руководи својим професионалним обимом праксе и јурисдикцијом лиценцирања. Користимо функционалне здравствене и веллнесс протоколе за лечење и подршку нези повреда или поремећаја мишићно-скелетног система.
Наши видео снимци, постови, теме, теме и увиди покривају клиничка питања, проблеме и теме које се односе на и директно или индиректно подржавају наш клинички обим праксе.*
Наша канцеларија је разумно покушала да обезбеди цитате у прилог и идентификовала је релевантну истраживачку студију или студије које подржавају наше објаве. На захтев пружамо копије пратећих истраживачких студија доступне регулаторним одборима и јавности.
Разумемо да покривамо питања која захтевају додатно објашњење како то може помоћи у одређеном плану неге или протоколу лечења; зато, да бисте даље разговарали о горњој теми, слободно питајте Др Алек Јименез, ДЦ, или нас контактирајте 915-850-0900.
Овде смо да помогнемо вама и вашој породици.
Благослови
Др. Алек Јименез ДЦ, МСАЦП, РН*, ЦЦСТ, ИФМЦП*, ЦИФМ*, АТН*
e-маил: цоацх@елпасофунцтионалмедицине.цом
Лиценцирани као доктор киропрактике (ДЦ) у Тексас & Нови Мексико*
Тексас ДЦ лиценца бр. ТКСКСНУМКС, Нев Мекицо ДЦ Лиценца # НМ-ДЦ2182
Лиценцирана као медицинска сестра (РН*) in Флорида
Флорида лиценца РН лиценца # РНКСНУМКС (Контролни бр. 3558029)
Компактни статус: Вишедржавна лиценца: Овлашћени за праксу у КСНУМКС државе*
Др Алек Јименез ДЦ, МСАЦП, РН* ЦИФМ*, ИФМЦП*, АТН*, ЦЦСТ
Моја дигитална визит карта